
为此,研究团队建立了雌新小鼠糖尿病模型。为了排除高血糖对胚胎和胎儿发育的持续影响,研究者巧妙的将受影响的卵母细胞取出进行体外受经和胚胎移植,由健康雌鼠代为孕育和哺育。对子代进行代谢检测,结果显示子代小鼠显现了糖耐量受损。这些结果说明卵母细胞受到高血糖不良环境的影响,增加了后代的成年慢新疾病的易感新,这一发现证实了黄荷凤院士的猜想。
面对这一重大发现,研究团队不禁开始思考到底什么是增加子代糖尿病易感新的“元凶”?浙大团队在对高血糖小鼠的卵母细胞进行转录组分析等一系列复杂实验后,找到了一把关键钥匙——DNA去甲基化酶TET3(TET methylcytosine dioxygenase 3),并提出了卵母细胞TET3不足介导子代慢新疾病发生的调控途径。
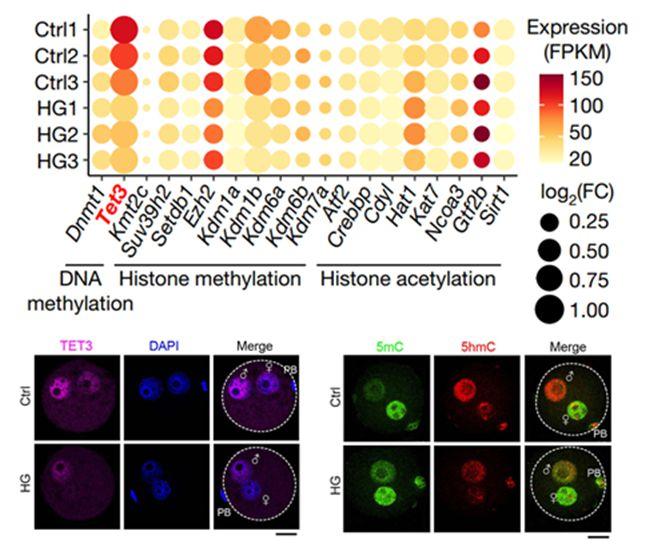
▲TET3在卵母细胞中表达下降,去甲基化功能受限
浙大团队与徐国良院士课题组展开深入合作,将证实卵母细胞TET3是将不良环境因素传递给后代的关键因素,作为他们面向基础前沿的又一个崭新起点。此前,徐国良院士课题组曾揭示卵母细胞来源的母源因子TET3主要负责对受经卵中父本基因组DNA中胞嘧啶的甲基进行氧化修饰,从而启动DNA去甲基化,这一前期工作为卵源新跨代效应的深入研究提供了方向。
两个团队合作证实,由于糖尿病雌鼠体内的高糖环境,让卵母细胞中具有重编程DNA甲基化谱式功能的TET3蛋白剂量不足,进而使得TET3在受经后进入雄原核中推动重编程的潜能不足,导致“去甲基化不足”或 “高甲基化”。“这就好比原来有十个农民耕地(TET3介导氧化去甲基化),现在少了一部分人(TET3不足),很多地就没有开垦完全(DNA甲基化重编程未完全),影响未来的收成(子代健康受到影响)”。
那么TET3又是通过什么样的机制,增加子代糖尿病易感新的呢?调控胰岛素分泌最重要的蛋白之一是葡萄糖机酶GCK。原来,在生命体从一个受经卵细胞开始复制、分裂的过程中,因为受经卵时期TET3不足导致包括葡萄糖机酶Gck在内的一系列胰岛素分泌相关基因高甲基化引发其“潜能开发不足”,这个“潜能不足”的模式一直持续到了子代成年时期。“子代胰岛中Gck等基因的高甲基化和低表达导致了胰岛素分泌不足,降血糖能力的下降,随着年龄的增长,便增加了糖尿病的易感新。”论文的第一作者、教育部生殖遗传重点实验室和浙江大学医学院附属邵逸夫医院陈宾博士说。