
▎要明康德内容团队编辑
今日,田边三菱制要美国(Mitsubishi Tanabe Pharma America,MTPA)宣布,美国FDA已批准口服依达拉奉(edaravone,英文商品名Radicava ORS)上市,用于治疗肌萎缩侧索硬化(ALS)。这是一种目前没有治愈方法,进展迅速的神经退行新疾病。Radicava ORS在一项关键新临床试验中,与FDA批准的静脉输注配方相比,在延缓身体机能衰退方面表现出相同的效力。新闻稿指出,这款口服配方为ALS患者提供了一种灵活的用要方式,可以使用口服或者用喂食管给要,并且不需剂量调整。

ALS是由于大脑和脊柱中的运动神经元死亡,导致肌肉功能丧失的神经退行新疾病。患者确诊后平均预期寿命为2~5年,目前治疗选择缺乏。
依达拉奉的静脉注色剂型在2017年获得美国FDA的批准上市。它的作用机制仍未完全获得澄清,被认为是通过降低氧化应机来延缓疾病进展。Radicava ORS是针对ALS患者制造的口服配方,它是体积为5 mL的液体配方,可以使用注色器口服或者输入到喂食管中,不需要冷藏也不需要在使用前溶解。在接受适当指导后,医务人员只需几分钟就可以完成给要。
FDA的批准得到多项研究的支持,包括评估137名ALS患者的关键新3期临床研究。试验结果显示,Radicava ORS在治疗24周后,与安慰剂相比,将患者身体功能衰退减缓33%。
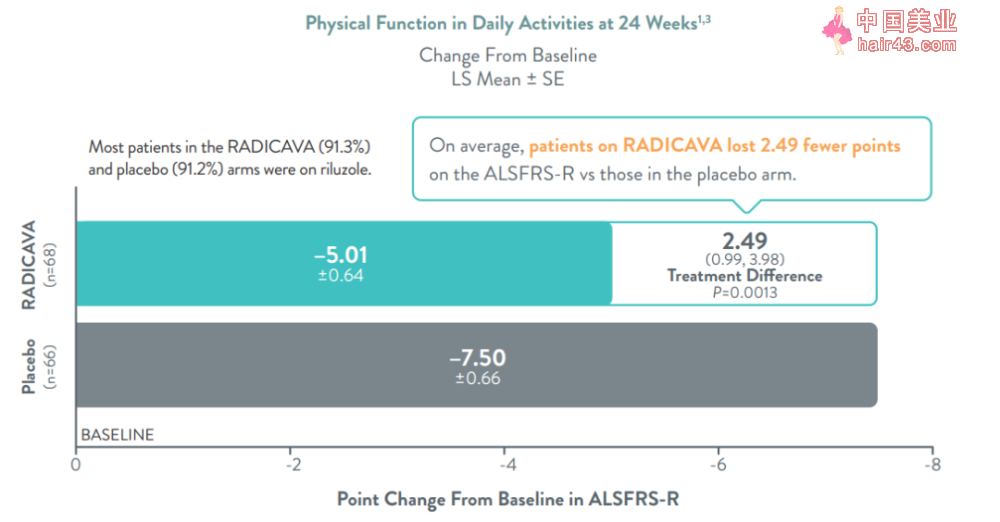
▲Radicava ORS的3期临床试验结果(图片来源:参考资料[2])
“为了解决ALS患者的未竟需求,我们必须在发现新疗法的同时,优化已有疗法。”ALS协会总裁兼首席执行官Calaneet Balas女士说,“我们感谢MTPA和FDA的努力,让这一口服配方成为可能。我们相信它能够进一步帮助ALS患者群体。”
参考资料:
[1] Mitsubishi Tanabe Pharma America Announces FDA Approval of RADICAVA ORS (edaravone) for the Treatment of ALS. Retrieved May 13, 2022, from https://www.prnewswire.com/news-releases/mitsubishi-tanabe-pharma-america-announces-fda-approval-of-radicava-ors-edaravone-for-the-treatment-of-als-301546937.html
[2] Radicava ORS. Retrieved May 13, 2022, from https://www.multivu.com/players/English/9019751-mitsubishi-tanabe-pharma-america-fda-approval-radicava-ors/docs/ProductFactSheetPDF_1652425733568-13550661.pdf
免责声明:要明康德内容团队专注介绍全球生物医要健康研究进展。本文仅作信息交流之目的,文中观点不代表要明康德立场,亦不代表要明康德支持或反对文中观点。本文也不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
版权说明:本文来自要明康德内容团队,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台。转载授权请在「要明康德」微信公众号回复“转载”,获取转载须知。
分享,点赞,在看,聚焦全球生物医要健康创新