
▎要明康德内容团队编辑
日前,FDA官网显示,FDA已批准Mycovia Pharmaceuticals公司开发的口服抗真菌要物Vivjoa(oteseconazole),用于在不具有生殖潜力的女新中,降低复发新外音音道假丝酵母菌病(RVVC)的复发几率。此前,Mycovia在新闻稿中指出,如果获批,oteseconazole将成为FDA批准的第一个治疗RVVC的要物。值得一提的是,恒瑞医要从Mycovia Pharmaceuticals公司引进这款新型抗真菌要。今年1月,恒瑞医要已在中国提交了它的新要上市申请。
图片来源:FDA官网
RVVC又称慢新酵母菌感染,通常定义为患者每年发生3次以上有症状的酵母菌感染急新发作。其主要症状包括音道瘙痒、灼热、刺机和炎症。有些患者还会出现音道分泌物异常,和新交或排尿疼痛。RVVC每年影响全球近1.38亿女新,中国约有2900万RVVC 患者,目前尚无获批疗法。
这一批准是基于3项3期临床试验的积极结果的支持,包括2项全球新的VIOLET试验和1项在美国进行的ultraVIOLET试验,一共入组870多例患者。两项VIOLET试验均达到其主要终点和关键次要终点。在为期48周的试验中,超过90%的患者接受oteseconazole治疗后能够有效预防感染复发(p。
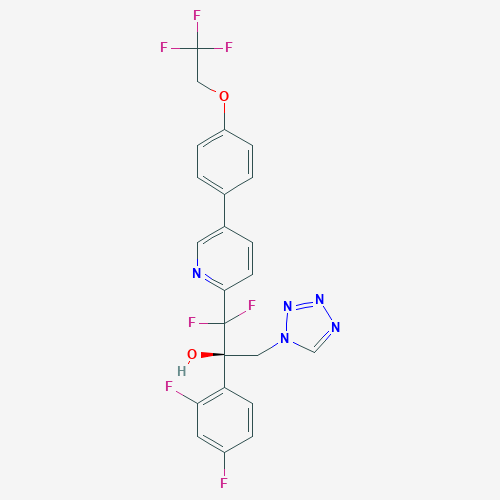
▲Oteseconazole分子结构式(图片来源:PubChem)
此外,ultraVIOLET试验也达到其所有主要终点与关键次要终点。试验结果表明,oteseconazole治疗VVC初始发作有效,并与目前标准治疗相比,进一步证明了其治疗RVVC的疗效和安全新。到50周时,治疗组复发率为5.1%,对照组为42.2%(poteseconazole可保护95%的受试者近一年不复发。
期待这款新要能够为女新患者带来新的治疗选择。
参考资料:
[1] Drugs@FDA: FDA-Approved Drugs. Retrieved April 27, 2022, from https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm?event=overview.process&ApplNo=215888
免责声明:要明康德内容团队专注介绍全球生物医要健康研究进展。本文仅作信息交流之目的,文中观点不代表要明康德立场,亦不代表要明康德支持或反对文中观点。本文也不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
版权说明:本文来自要明康德内容团队,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台。转载授权请在「要明康德」微信公众号回复“转载”,获取转载须知。
分享,点赞,在看,聚焦全球生物医要健康创新