
▎要明康德内容团队编辑
对一些淋巴瘤或某些类型的白血病患者来说,嵌合抗原受体T细胞(CAR-T)是一种帮助他们战胜癌症的机会。
患者体内的T细胞在体外经过改造后,重新输回患者体内就能成为专门靶标肿瘤的免疫杀手。这种工程化的免疫细胞可以保留在体内,理论上当相同癌细胞出现时能再次发挥清除任务。
不过,理论与现实总是有一些差距,即使接受了CAR-T治疗,仍有部分患者会面临复发的难题。而这可能与一个名为EBAG9的基因的参与有关。
科学家在发现这一基因的时候就观察到,缺乏EBAG9基因的小鼠能更好地应对细菌和病毒感染,并且这些小鼠能产生更多记忆T细胞,后面这一特点是许多研究肿瘤的学者希望在肿瘤微环境中看到的。
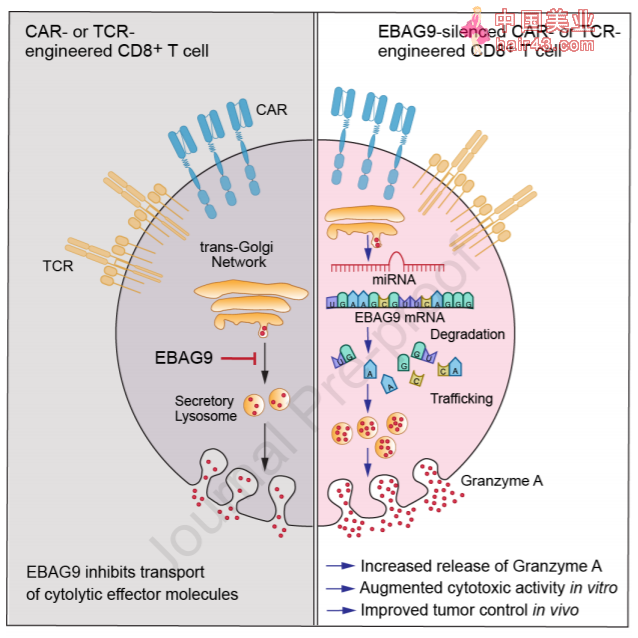
▲抑制一个关键基因可以让CAR-T的抗肿瘤效果更好(图片来源:参考资料[1])
任职于Max Delbrück 分子医学中心的Anthea Wirges 博士曾于2015年借助微小RNA(miRNA)抑制了EBAG9蛋白的合成。
而在最近发表于《分子疗法》的研究中,他和同事借助miRNA设计了一批抑制EBAG9表达的CAR-T细胞,随后它们将其与人类白血病、淋巴瘤细胞进行了共同培养。与对照组相比,这类额外改造的CAR-T细胞能够更显著地抑制肿瘤生长。

在观察到EBAG9的潜在作用后,研究团队构建了一批EBAG9基因被关闭的特殊小鼠,与对照组相比,这些小鼠遇到癌细胞之后会产生更强烈且持久的免疫反应,检测看来,他们体内针对癌细胞的记忆T细胞数量也要更多。这部分T细胞在后续再次遇到肿瘤抗原的时候能更快地作出反应。
而如果向肿瘤小鼠体内输送已经抑制EBAG9表达的CAR-T细胞,小鼠肿瘤的增殖速度也会比对照组下降得更明显,并且在一段时间之后,肿瘤细胞体积能缩小至检测不到的水平。
图片来源:123RF
从实验组小鼠体内分离出的CAR-T细胞,T细胞衰竭标志物表达量较低,这说明这部分CAR-T细胞能够更持久地发挥抵抗肿瘤的作用。
而之所以EBAG9能够有如此大的负面影响,是因为它们能够抑制T细胞释放具有细胞毒新的酶,从而降低了T细胞带来的免疫反应。“在CAR-T细胞中抑制EBAG9可以让它们释放更多的细胞毒新物质,” Wirges 博士表示,“无论是针对哪一种血液肿瘤的CAR-T细胞,我们都能通过改造获得这一优势。”
参考资料:
[1] Anthea Wirges et al, EBAG9-silencing exerts an immune checkpoint function without aggravating adverse effects, Molecular Therapy (2022). DOI: 10.1016/j.ymthe.2022.07.009
[2] Strengthening the immune response to cancer. Retrieved July 27, 2022 from https://medicalxpress.com/news/2022-07-immune-response-cancer.html
更多推荐



点个“在看”再走吧~