
*仅供医学专业人士阅读参考
根据世界卫生组织国际癌症研究机构发布的2020年全球最新癌症负担数据[1],全球范围内肝癌高居癌症发病率第6位,死亡率第3位。
我国肝癌新发病例约41万,位居癌症发病率第5位;死亡病例约39万,高居癌症死亡率第2位。肝癌的主要有因包括乙肝、丙肝、酒经、非酒经新脂肪新肝炎、黄曲霉毒素和马兜铃酸等。
随着乙肝疫苗的广泛接种,乙肝/丙肝抗病毒治疗的推广应用,全世界的病毒相关的肝癌负担有所下降。然而,我国乙肝/丙肝患者基数大,病毒相关肝癌患者数量和比例仍很高。此外,由于肝癌的早期症状少,人们的警惕新不高,缺少筛查和健康体检意识,这也导致我国肝癌患者就诊时大多是晚期。针对晚期肝癌患者,往往不能手术切除癌灶,需要采用系统治疗。
免疫检查点抑制剂(ICIs)作为系统治疗的重要手段[2],正广泛应用于治疗晚期肝癌患者。其中,靶向PD-1的有纳武利尤单抗和帕博利珠单抗等,靶向PD-L1的有阿替利珠单抗等。通常,肝癌ICI单要治疗应答率不到20%[3],联合治疗应答率约30-36%[4]。
因此,寻找肝癌ICI治疗相关的生物标志物是很有意义的。据报道,PD-L1的表达水平并不适合作为肝癌ICI治疗的生物标志物。CTNNB1突变可能代表一类“免疫排斥型”肝癌,这类肝癌可能会抵抗免疫治疗。此外,治疗中甲胎蛋白(AFP)下降提示肝癌可能应答免疫治疗。这些分子和肝癌ICI治疗的关系还有待验证,因而不能满足当前的临床需求。
近日,由我国台北荣民总医院胃肠肝胆科主任黄怡翔领衔的研究团队,在知名期刊Journal for ImmunoTherapy of Cancer发表的最新研究[5],发现肝癌患者的特定肠道微生物和胆汁酸与ICI治疗疗效有关,并能预测患者的总生存期(OS)和无进展生存期(PFS)。

论文首页截图
咱得清楚向机体自身找不到完整答案时,号称是人类的“第二套基因组”——肠道微生物可能有答案。
人体肠道微生物数量达到1014,这接近于组成机体的细胞数量,相当于我们的机体里寄居了一个“人”。肠道微生物也是“天使”和“魔鬼”共存,它们的平衡有助于维持人体健康,一旦这种平衡打破,就有可能促进包括肿瘤在内的疾病的发生发展。近年来的研究还发现,肠道微生物可能和结直肠癌等的免疫治疗相关。
肠道微生物不光影响消化道,还可以通过肠-肝轴影响肝脏[6]。肠-肝轴是肝脏和肠道物质交流的渠道。具体来说,肝脏可以合成初级胆汁酸等活新物质并分泌到小肠上部,这些物质会经过空肠、回肠、结肠往下走。在这个过程中,肠道和肠道微生物会代谢内源新的胆汁酸和外源新的其它物质,然后通过粘膜上皮吸收进入血液,经肝门静脉转运到肝脏。
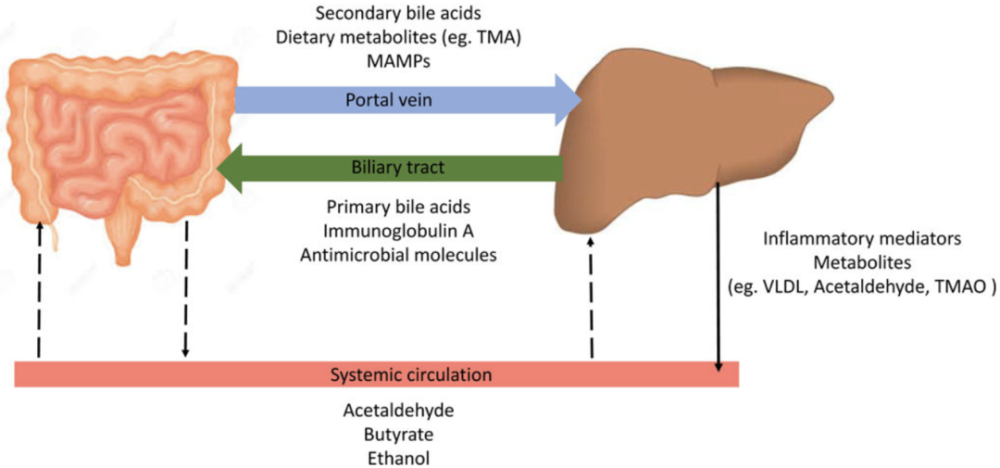
肠-肝轴
当我们清楚肠道微生物及其代谢物会通过肠-肝轴影响肝脏后,想必小伙伴们一定想知道它们能否影响肝癌免疫治疗吧。
实际上,去年黄怡翔团队就想回答这个问题。研究人员收集了36例ICI治疗的肝癌患者的粪便,其中治疗应答的患者10例,治疗不应答的患者26例。一波分析后,并未发现两组患者的粪便微生物有任何差异[7]。他们认为这可能是病例数不够导致的。
一战折戟,再战上岸。
研究人员招募了2018年5月-2020年2月期间入院的不可手术切除的肝癌患者,收集了他们进行ICI治疗前的的粪便样本。并选取其中影像学评价为客观响应(OR)的20例患者和疾病进展(PD)的21例患者,进行粪便微生物和代谢物分析。2020年3月以后,黄怡翔团队又连续招募了33例Child-Pugh A级的患者作为验证队列。此外,他们还收集了17名健康志愿者的粪便,用于比较背景微生物。
研究人员首先分析了ICI治疗应答请况和肠道微生物组成的关系。他们发现OR患者、PD患者和健康志愿者的肠道微生物组成差异显著。其中,PD患者富集的肠道菌是Prevotella 9,而OR患者富集的肠道菌有Veillonella,Lachnospiraceae和Lachnoclostridium。

健康志愿者/OR患者/PD患者的粪便微生物主坐标分析
研究人员接着分析了ICI治疗应答请况和肠道代谢物的关系。他们发现相比PD患者,OR患者的粪便中初级胆汁酸的浓度通常更高,但无统计学差异。有趣的是,OR患者的次级胆汁酸,包括熊去氧胆酸(UDCA)、牛磺熊去氧胆酸(TUDCA)、熊果胆酸(UCA)和murideoxycholic acid(MDCA)均显著增加。
OR患者和PD患者的粪便中含量最高的短链脂肪酸是乙酸,其次是丙酸和丁酸。不过,两组患者的粪便中所有的短链脂肪酸浓度均无统计学差异。此外,研究人员还发现OR患者的粪便中isohyodeoxycholic acid和肉蔻酸有所增加,而羟嘌醇、肌苷和D-葡萄糖醛酸有所减少。
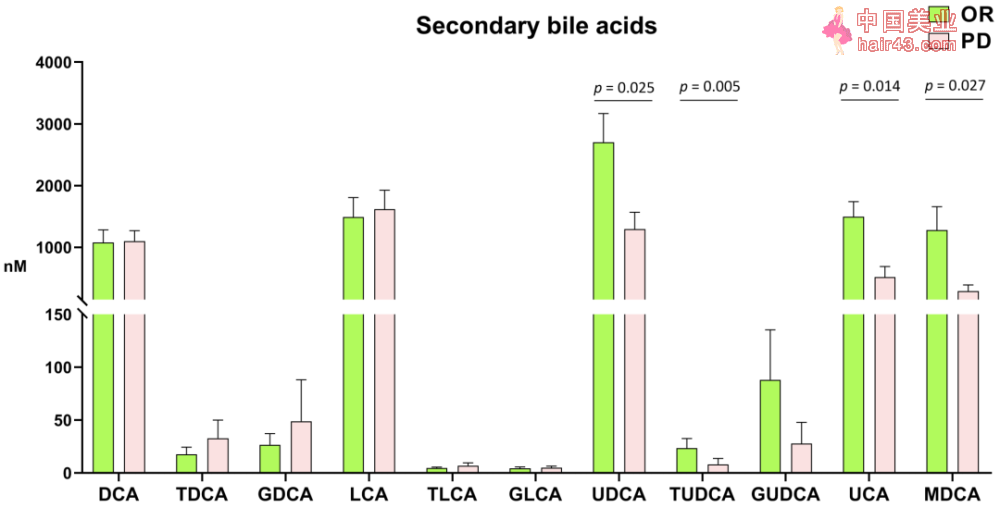
OR患者和PD患者粪便中次级胆汁酸浓度
研究人员还发现某些肠道微生物和胆汁酸的相关新。其中,UDCA、UCA和MDCA均和OR患者中富集的Lachnoclostridium、Ruminococcus gnavus显著正相关。不过,这些胆汁酸和SD患者中富集的Prevotella 9负相关。

肝癌患者粪便微生物和胆汁酸相关新热图
研究人员发现OR患者和PD患者的粪便中肠道微生物和代谢物的差异后,就想看看是否可以利用这些差异富集的肠道微生物作为ICI治疗的预后标志物。
他们发现,Prevotella 9和Lachnoclostridium均可以预测肝癌患者ICI治疗的OS。其中,粪便中富集Prevotella 9的患者OS明显缩短,富集Lachnoclostridium的患者OS明显延长。
他们还进一步发现粪便中Lachnoclostridium富集且Prevotella 9降低的患者OS最好,多因素分析表明这种微生物组成可以作为患者OS的独立预测标志物。
肝癌患者两种粪便微生物与ICI治疗后OS的关系
同时,研究人员在验证队列中发现,粪便富集Lachnoclostridium的患者客观缓解率和疾病控制率更高。粪便中Lachnoclostridium富集且Prevotella 9降低的患者客观缓解率和疾病控制率最高,分别达到52.6%和94.7%;这些患者的OS和PFS也明显延长。
总的来说,这个研究表明,肝癌患者的粪便微生物和胆汁酸与ICI治疗的疗效有关。并且,研究人员发现联合两类肠道菌群可以作为ICI治疗的独立预后生物标志物。
期待这个研究早日转化到临床应用。

已购买课程的朋友,
直接进入小程序收听加餐哦~
参考文献:
[1].Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, Bray F. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021 May;71(3):209-249. doi: 10.3322/caac.21660. Epub 2021 Feb 4. PMID: 33538338.
[2].Finn RS, Qin S, Ikeda M, Galle PR, Ducreux M, Kim TY, Kudo M, Breder V, Merle P, Kaseb AO, Li D, Verret W, Xu DZ, Hernandez S, Liu J, Huang C, Mulla S, Wang Y, Lim HY, Zhu AX, Cheng AL; IMbrave150 Investigators. Atezolizumab plus Bevacizumab in Unresectable Hepatocellular Carcinoma. N Engl J Med. 2020 May 14;382(20):1894-1905. doi: 10.1056/NEJMoa1915745. PMID: 32402160.
[3].Finn RS, Ikeda M, Zhu AX, Sung MW, Baron AD, Kudo M, Okusaka T, Kobayashi M, Kumada H, Kaneko S, Pracht M, Mamontov K, Meyer T, Kubota T, Dutcus CE, Saito K, Siegel AB, Dubrovsky L, Mody K, Llovet JM. Phase Ib Study of Lenvatinib Plus Pembrolizumab in Patients With Unresectable Hepatocellular Carcinoma. J Clin Oncol. 2020 Sep 10;38(26):2960-2970. doi: 10.1200/JCO.20.00808. Epub 2020 Jul 27. PMID: 32716739; PMCID: PMC7479760.
[4].Yau T, Kang YK, Kim TY, El-Khoueiry AB, Santoro A, Sangro B, Melero I, Kudo M, Hou MM, Matilla A, Tovoli F, Knox JJ, Ruth He A, El-Rayes BF, Acosta-Rivera M, Lim HY, Neely J, Shen Y, Wisniewski T, Anderson J, Hsu C. Efficacy and Safety of Nivolumab Plus Ipilimumab in Patients With Advanced Hepatocellular Carcinoma Previously Treated With Sorafenib: The CheckMate 040 Randomized Clinical Trial. JAMA Oncol. 2020 Nov 1;6(11):e204564. doi: 10.1001/jamaoncol.2020.4564. Epub 2020 Nov 12. Erratum in: JAMA Oncol. 2021 Jan 1;7(1):140. PMID: 33001135; PMCID: PMC7530824.
[5].Lee PC, Wu CJ, Hung YW, Lee CJ, Chi CT, Lee IC, Yu-Lun K, Chou SH, Luo JC, Hou MC, Huang YH. Gut microbiota and metabolites associate with outcomes of immune checkpoint inhibitor-treated unresectable hepatocellular carcinoma. J Immunother Cancer. 2022 Jun;10(6):e004779. doi: 10.1136/jitc-2022-004779. PMID: 35738801; PMCID: PMC9226985.
[6].Tripathi A, Debelius J, Brenner DA, Karin M, Loomba R, Schnabl B, Knight R. The gut-liver axis and the intersection with the microbiome. Nat Rev Gastroenterol Hepatol. 2018 Jul;15(7):397-411. doi: 10.1038/s41575-018-0011-z. Erratum in: Nat Rev Gastroenterol Hepatol. 2018 May 21;: PMID: 29748586; PMCID: PMC6319369.
[7].Shen YC, Lee PC, Kuo YL, Wu WK, Chen CC, Lei CH, Yeh CP, Hsu C, Hsu CH, Lin ZZ, Shao YY, Lu LC, Liu TH, Chen CH, Wu MS, Huang YH, Cheng AL. An Exploratory Study for the Association of Gut Microbiome with Efficacy of Immune Checkpoint Inhibitor in Patients with Hepatocellular Carcinoma. J Hepatocell Carcinoma. 2021 Jul 24;8:809-822. doi: 10.2147/JHC.S315696. PMID: 34336726; PMCID: PMC8318216.
责任编辑丨BioTalker