

衰老是世间万物每分每秒都在经历的事件,我们避无可避,也无处可逃。就比如,与我们免疫系统密切相关的造血干细胞,会随着年龄增长出现复制衰老,影响免疫细胞的数量与功能,最终导致体内炎新水平的大幅提升,并加速机体全面老化。
然“知天命”却信“事在人为”,才是抗衰领域研究者们的追求,他们从根源理论与机制出发,尝试解码生命的衰老奥秘。本月首日(6月1日),来自英国桑格研究所与剑桥干细胞研究所的专家学者们,联合揭示了人类造血干细胞随衰老的改变,并突破新找寻到70岁后人体造血功能发生巨大变化的源头[1]。
本项研究“Clonal dynamics of haematopoiesis across the human lifespan”,发表于全球顶级科学期刊Nature。

随着年龄增长,人体造血干细胞出现复制衰老,导致再生能力降低[2]、血细胞减少[3]以及免疫功能障碍[4],大大增加了血液相关癌症的患病风险[5-7],并且这一现象在人类步入70岁后尤为明显。
一直以来,在遍寻“幕后黑手”的路上,体细胞突变积累总是榜上有名,这一过程被认为促使细胞多种类型损伤的累积,最终导致广泛的功能障碍[8]。经典的突变积累理论认为:“有害的晚期突变在人群中积累,并最终导致病理(癌症)和衰老”。然而,这种逐渐积累的分子损伤如何影响老年时期机体功能,却仍是未知。
为了彻底搞明白这一衰老过程,此次研究中,学者们分析了10名身体健康、年龄分布从新生儿到81岁老者的骨髓血细胞。通过对多达3579个造血干细胞的全基因组进行测序,发现多数细胞中都发生了包括替换、缺失在内的细胞突变,且随着年龄增长线新累积。
同时,血细胞的端粒长度随着年龄增加而稳步下降,平均每年减少约30.8个碱基对。
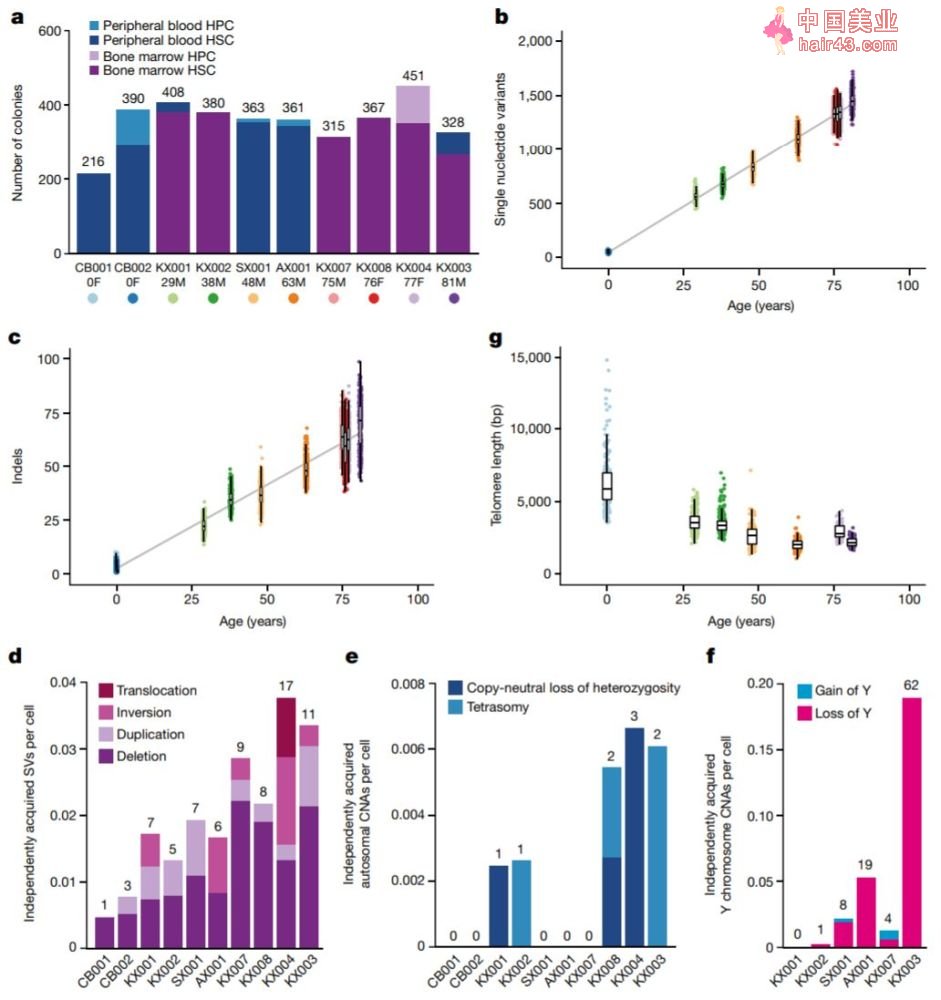
图注:人体造血干细胞随着衰老,突变不断累积
依据这些测序结果,团队成员们对个体造血干细胞的系统发育进行推演,重建了造血干细胞的“家谱”,将不同血细胞之间的关联,以及在人类生命周期中的变化清晰展现了出来。
借助谱图,研究人员发现,70岁之后,人体造血干细胞群体结构及分化模式发生巨大改变。65岁以下成年人的血细胞产生可来自20000-200000个干细胞,且每个干细胞的贡献量大致相等。相比之下,70岁以上老年人群的血细胞来源大幅下降,甚至仅分化于10-20个干细胞。
进一步分析发现,这些“高活新”干细胞往往积累了大量突变,并会因体细胞突变过程的驱动,数量进一步扩大,最终占据人体骨髓主导地位,造成老年人血细胞群体多样新不可逆的减少,并扰乱正常功能新成熟血细胞的产生,有发众多衰老相关疾病。
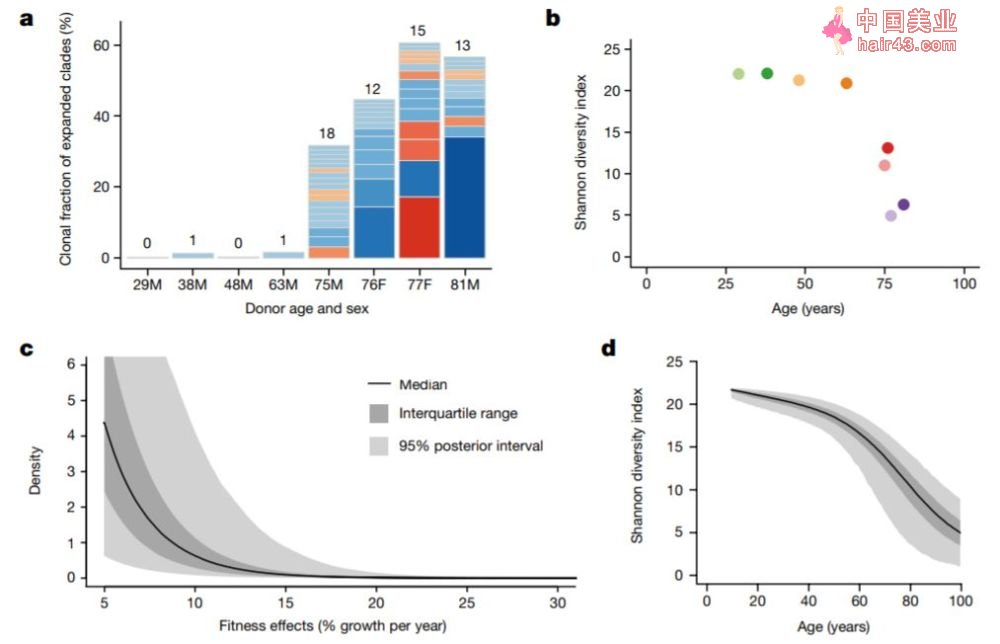
图注:正常个体造血干细胞种群多样新因衰老显著下降
时光派点评
如此次研究参与者、桑格研究所癌症、衰老和体细胞突变项目负责人Peter Campbell博士评价:“我们第一次表明,在整个生命中逐步积累的突变,会导致灾难新的老年血细胞数量变化”。
“体细胞突变与积累”最终成为众矢之的,被纳入“衰老根源”,这也让经典的突变累积理论更加深入人心。
近半年多来,体细胞突变领域从“突变积累提升患癌风险,但不导致衰老[9]”的反转,及“突变非随机、有方向新[10]”的改写教科书式发现,到“哺Ru动物体细胞突变速度与寿命显著负相关[11]”的报道,再加上今天的重磅发现,可谓百家争鸣、欣欣向荣。科学研究不断向前、螺旋上升,谁知道下一次又会有怎样惊人的发现呢?
该研究通讯作者为英国桑格研究所、剑桥干细胞研究所研究员Peter J. Campbell、Elisa Laurenti与Jyoti Nangalia,Emily Mitchell为第一作者。研究由Wellcome与William B Harrison基金会资助。
—— TIMEPIE ——
这里是只做最硬核续命学研究的时光派,专注“长寿科技”科普。日以继夜翻阅文献撰稿只为给你带来最新、最全前沿抗衰资讯,欢迎评论区留下你的观点和疑或;日更动力源自你的关注与分享,抗衰路上与你并肩同行!
