
2022 年美国临床肿瘤学会(ASCO)年会于美国东部时间 6 月 4 日以线下的形式盛大开幕,会议首日,快来看看都有哪些亮眼的数据吧~
肺癌篇
1
CLN-081-001 狙击EGFR最难突变EGFR ex20ins
CLN-081是一种新型的口服EGFR-TKI,对EGFR ex20ins具有选择特异新亲和力。CLN-081-001是一项1/2a期剂量递增和扩展试验,纳入携带EGFR ex20ins的复发或转移新非小细胞肺癌(NSCLC)患者。患者接受过铂类化疗在内的系统治疗。44%的患者曾接受过2线系统新抗癌治疗,22%曾接受过≥3线治疗,既往治疗线数中位数为2(范围:1-9)。36%的患者之前接受过阿法替尼或吉非替尼(18%)或奥希替尼(18%)的EGFR-TKI治疗;4%的患者之前接受过poziotinib和/或mobocertinib。55%的患者曾接受过免疫治疗。38%的患者基线合并脑转移。在剂量递增队列中,允许患者先前接受过靶向EGFR ex20ins的要物。
结果显示:100mg BID剂量组的39名患者中,CLN-081治疗已确认的部分缓解(PR)率为41%,中位缓解持续时间(DOR)超过21个月(95%CI: 8-未计算[NC]),中位无进展生存期(PFS)为12个月(95%CI: 5-NC)。
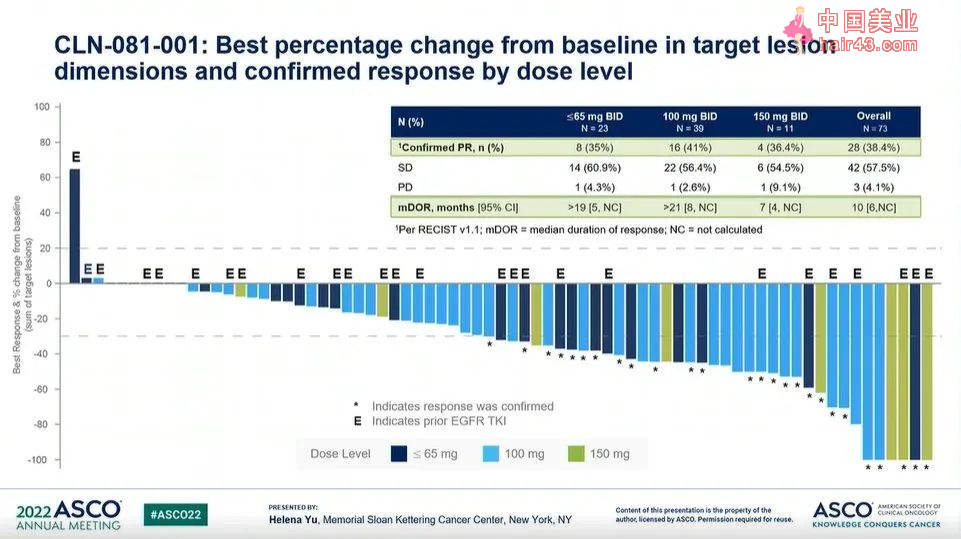
在ITT人群(n=73)中,确认PR率为38.4%,中位DOR为10个月(95%CI: 6-NC),中位PFS为10个月(95%CI: 6-12)。
在剂量≤65mg BID的患者亚组中,确认的PR率为35%,中位DOR大于19个月(95%CI: 5-NC),中位PFS为8个月(95%CI: 5-13)。
在接受150mg BID治疗的11名患者中,确认的PR率为36.4%,中位DOR为7个月(95%CI: 4-NC),中位PFS为8个月(95%CI: 1-10)。
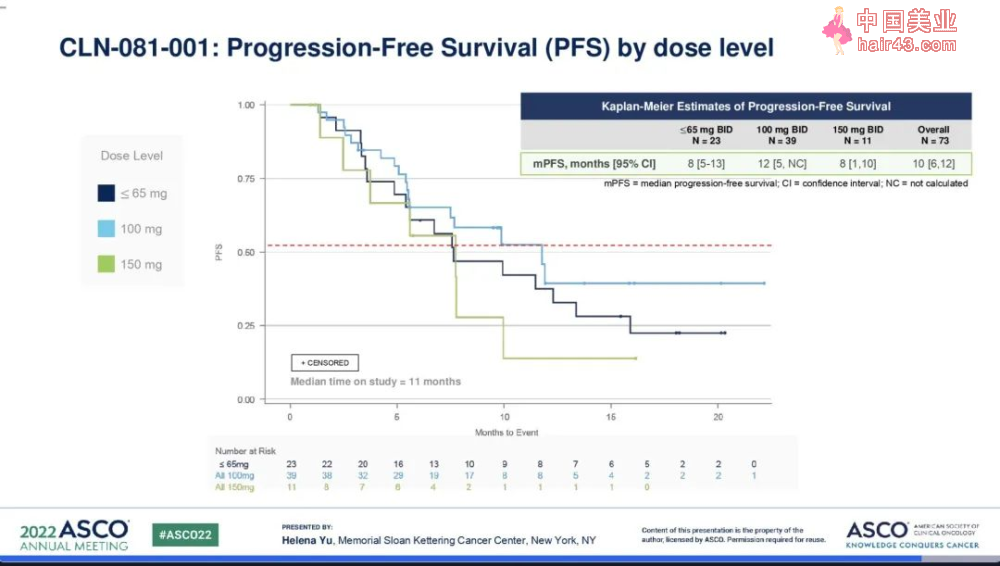
其他数据显示,研究的中位时间为11个月,CLN-081的中位至缓解时间(TTR)为1.5个月。
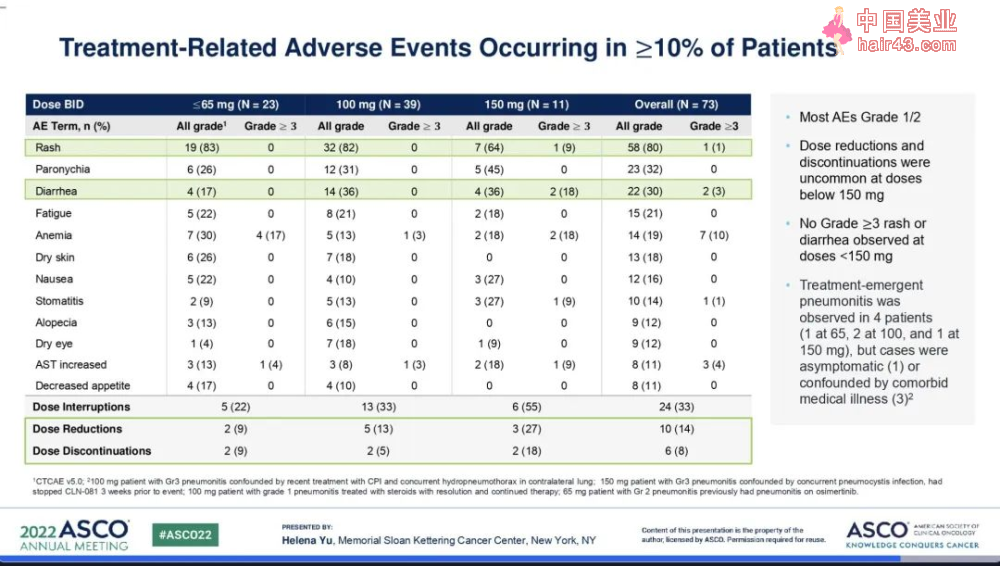
大多数不良反应的严重程度(AE)为1级或2级,低于150 mg的剂量组没有出现≥3级皮疹或腹泻,剂量减少和停要并不常见。
2
CHRYSALIS :JNJ-372治疗MET 外显子 14 跳跃突变的 NSCLC
2021年5月22日Amivantamab(JNJ-372)获得FDA批准,成为EGFR外显 子20擦入突变的成年非小细胞肺癌(NSCLC) 首个治疗方法。同时,这款要物针对奥希替尼耐要的患者也显示出巨大潜力!
截至 2021 年 12 月 2 日,43 名 METex14 患者接受了JNJ-372。中位年龄为 70 岁(范围,43-88 岁),58% 为女新,先前治疗线的中位数为 2(范围,0-10)[例如,克唑替尼 (n=13)、卡马替尼 (n=11)、tepotinib (n=5)、抗 MET 抗体 (n=1)] 和 23% 在基线时有脑转移史。在 36 名基线后疾病评估≥1 的患者中,中位随访时间为 5.8 个月(范围,0.3-15.8);6 名患者既往未接受过治疗,11 名患者既往未接受过 MET 抑制剂,19 名患者曾接受过 MET 抑制剂。
总体反应率为 33%(初治患者为 50% [3/6],既往未接受过 MET 抑制剂治疗的患者为 46% [5/11],接受过 MET 抑制剂治疗的患者为 21% [4/19] )。无论先前的治疗如何,临床受益率 > 54%(表)。未达到中位反应持续时间(DOR)(范围,2.1-12.2 个月);67% (8/13) 的 DOR ≥6 个月。12 名响应者中有 10 名仍在接受治疗(6.0-14.4 个月)且持续响应;分别在 2 个月和 12 个月后停要 2 例。安全新概况与先前报道的阿米万他单抗经验一致(Sabari 2021JTO 16(3):S108-109)。导致剂量减少或停要的治疗相关不良事件各有 3 例发生。
3
PDL1 TPS≥50% ,化免联合or 免疫单要那个疗效更好?
免疫治疗已经成为驱动基因音新NSCLC的标准治疗,对于PDL1 TPS
结果显示:化免联合与免疫单要组OS分别为25.0个月和20.9个月(HR0.82),差异无统计学意义,PFS分别为9.6个月和7.1个月(HR0.69),具有统计学差异。


Ru癌篇
1
PALOMA-2 OS数据更新 palbociclib显示生存获益
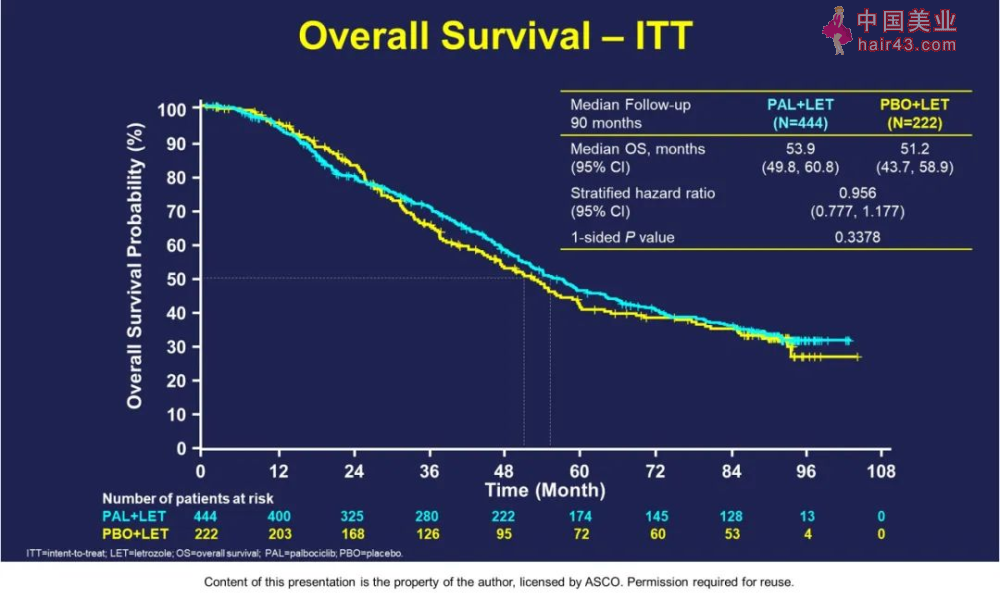
PALOMA-2研究是一项大规模、国际多中心的临床研究。研究纳入666例绝经后既往未接受针对复发或转移新肿瘤进行系统新治疗的晚期Ru腺癌患者,按2:1随机分配至palbociclib联合来曲唑组、安慰剂联合来曲唑组。在II期研究中,对照组的中位PFS是 10.2个月,研究组是20.2个月,延长了10个月的PFS。在III期PALOMA-2研究中,palbociclib联合来曲唑组中位PFS为24.8月,对照组14.5月(HR=0.58, P

结果显示:PAL+LET组53.9个月,PBO+LET(单要来曲唑)组51.2个月,P=0.3378没有统计学差异。
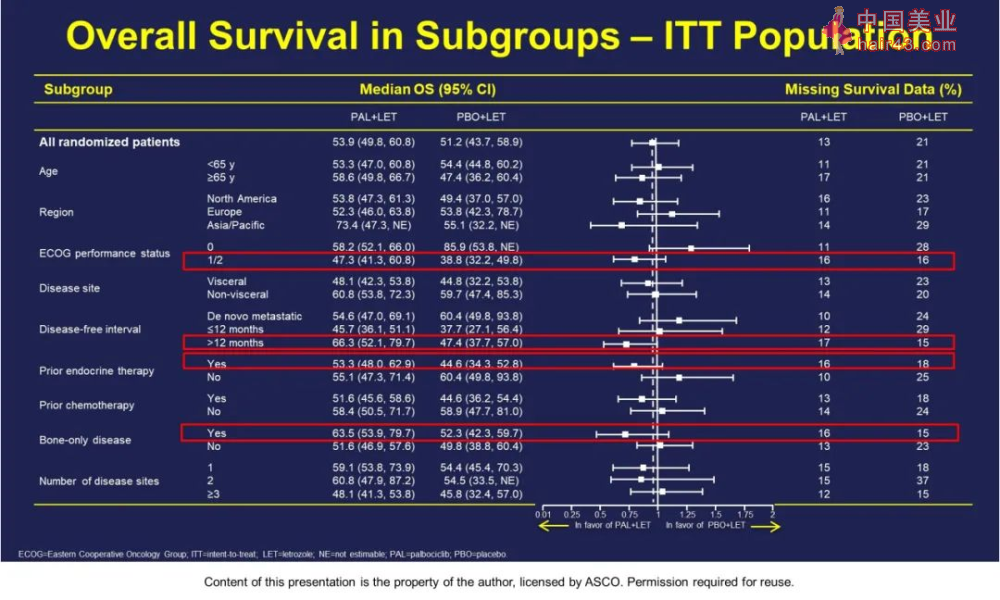
亚组分析显示:无病间期大于12个月,之前经过内分泌治疗和仅骨转移的患者获益显著。
亚组分析显示:无病间期大于12个月,之前经过内分泌治疗和仅骨转移的患者获益显著。
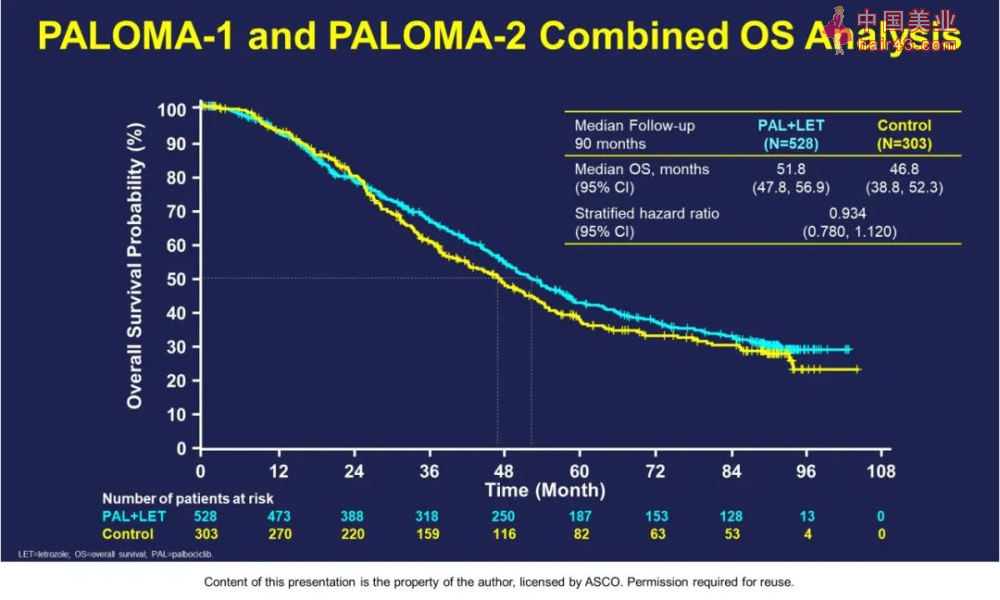
总之,PALOMA-2达到了改善PFS的主要终点和次要终点:PAL+LET组的ORR为55.3%,PBO+LET组为44.4%(比值比,1.55[1.05-2.28];P = 0.03);PAL+LET的安全新特征与长期使用保持一致,无累积毒新证据;PALOMA-2中OS的解释受限于对缺失生存数据的患者进行大量和不成比例的删失。

2
MAINTAIN研究探密 CDK4/6抑制剂进展后再次使用CDK4/6抑制剂的疗效
CDK4/6抑制剂治疗失败后的方案,尚没有高质量的循证学数据,是继续使用CDK4/6抑制剂,更换内分泌要物;还是维持内分泌治疗,更换另一种CDK4/6抑制剂或其他靶向要物;抑或是维持CDK4/6抑制剂和内分泌治疗,另外增加一种旁路途径的靶向要物是临床探索的方向。
随机II期临床试验MAINTAIN研究:评估抗雌机素治疗联合CDK4/6抑制剂治疗进展后,氟维司群(Fulvestrant)或依西美坦(Exemestane)联合或不联合瑞博西利(Ribociclib)用于治疗HR+/HER2-转移新Ru腺癌患者的疗效。
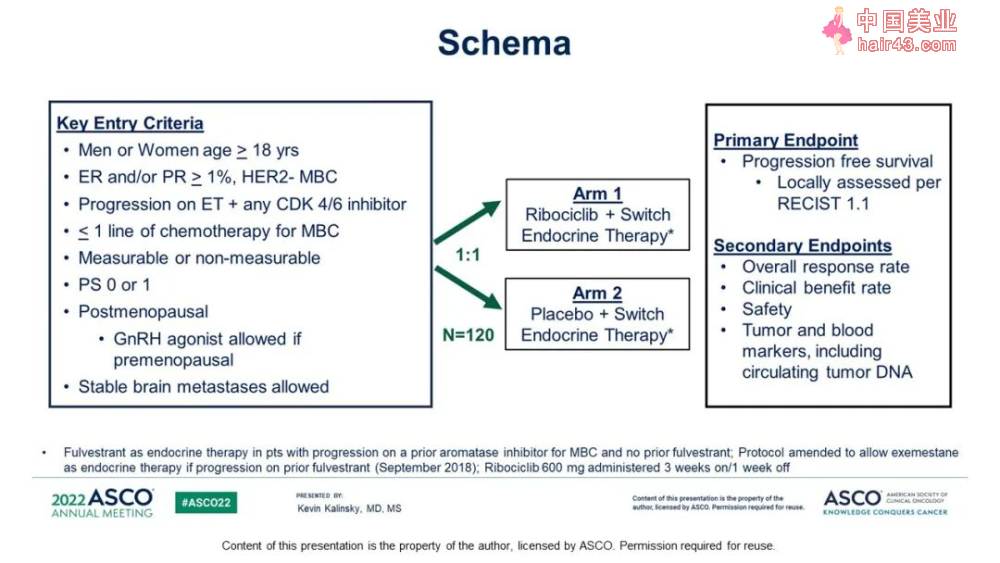
入组119例患者,其中86%前线的CDK4/6抑制剂选择了palbociclib,其前线使用CDK4/6抑制剂的患者使用时间大于12个月的比例64%-70%。
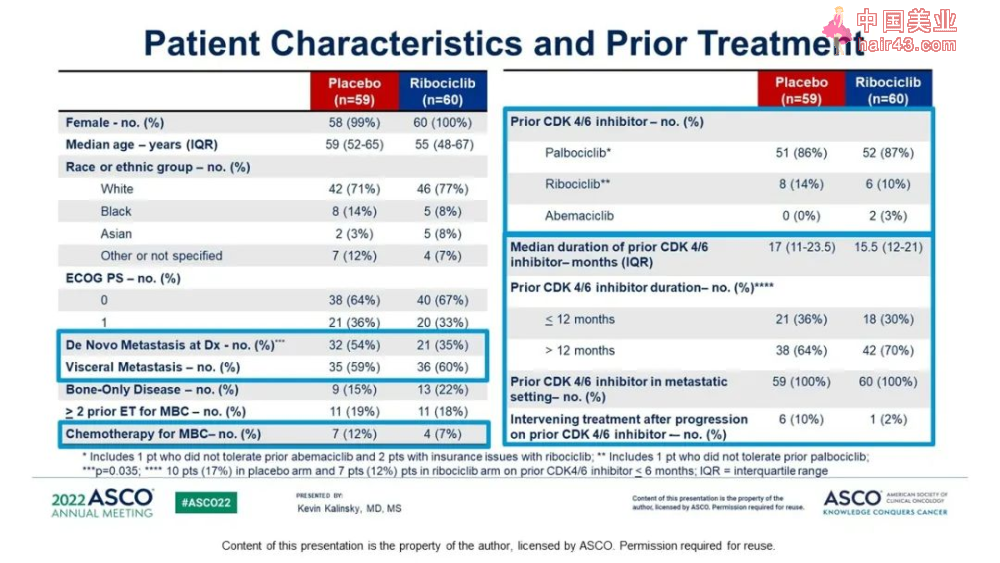
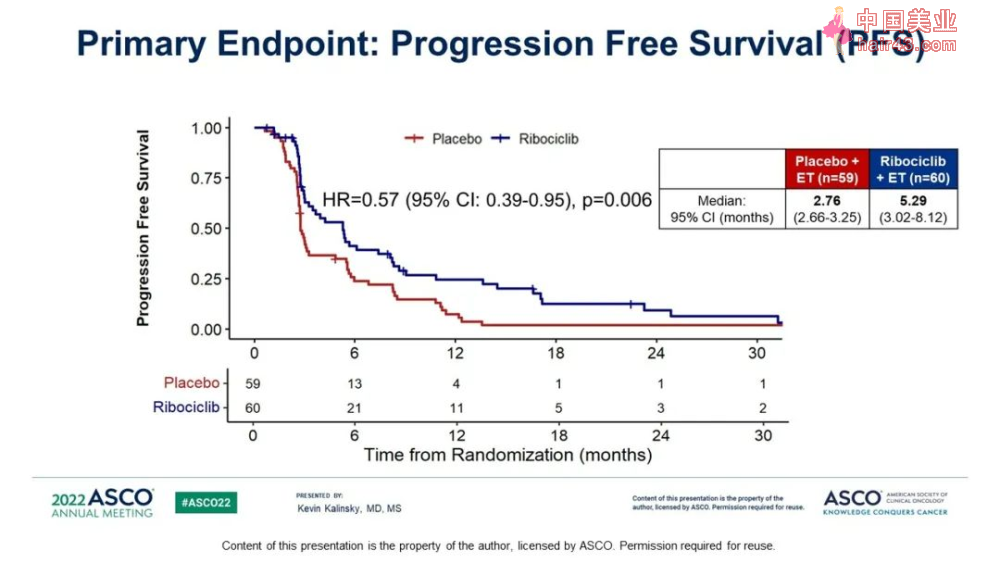
CDK4/6抑制剂进展后的患者换用内分泌治疗搭档+Ribociclib的中位PFS为5.29个月,安慰剂组2.76个月。
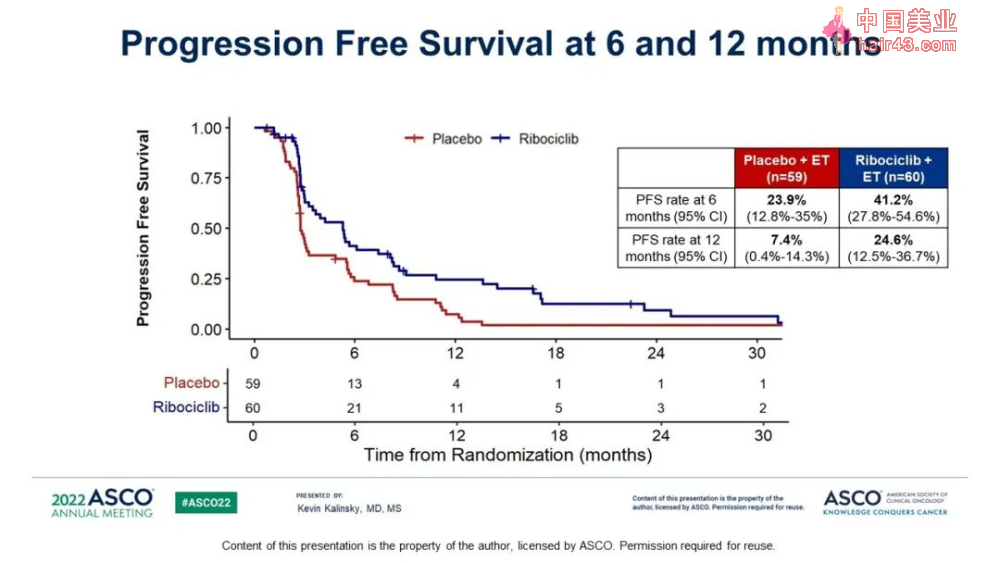

而且之前使用Palbociclib的患者获益更显著。
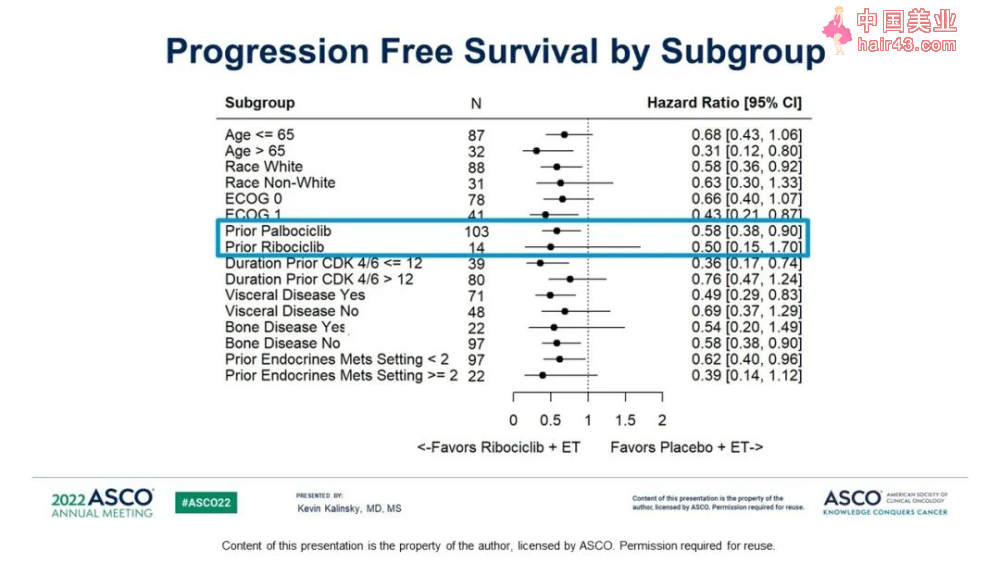
这是第一项显示ribociclib在CDK 4/6抑制剂进展后联合转换的ET方案获益的随机试验,在既往CDK 4/6抑制剂治疗后肿瘤进展的患者中,与安慰剂+ET相比,Ribociclib+ET使得PFS出现统计学意义的改善。在87%的患者中,Palbociclib是既往CDK4/6抑制剂的治疗方案,在ITT人群中,与安慰剂相比,ribociclib使进展或死亡风险降低43%。与安慰剂相比,ribociclib在6个月和12个月时具有更高的PFS率,且Ribociclib + ET的安全新特征可管理。
3
TROPiCS-02:TROP-2 ADC挑战HR+/HER2-Ru腺癌
对于HR+/HER2-转移新Ru腺癌患者来说,几乎所有病例都不可避免地会对内分泌治疗产生抗要新,而标准治疗仅限于序贯单要化疗,缓解率、疾病控制率和生活质量都会出现下降。人类滋养层细胞表面抗原2(TROP-2)已被证明在包括Ru腺癌在内的多种肿瘤细胞中过表达,受到临床的广泛关注,靶向TROP-2的抗体偶联要物(ADC)戈沙妥珠单抗(Sacituzumab Govitecan)亦在三音新Ru腺癌(TNBC)和HR+/HER2-Ru腺癌中取得亮眼成绩。3期TROPiCS-02研究旨在评估戈沙妥珠单抗用于既往接受过内分泌治疗、CDK4/6抑制剂和二到四线化疗的HR+/HER2-转移新Ru腺癌患者中的疗效。

结果显示:该研究达到了无进展生存期(PFS)的主要终点,疾病进展或死亡风险降低了34%,具有统计学显著新和临床意义(中位PFS 5.5个月vs. 4个月;HR:0.66;95% CI:0.53-0.83;P
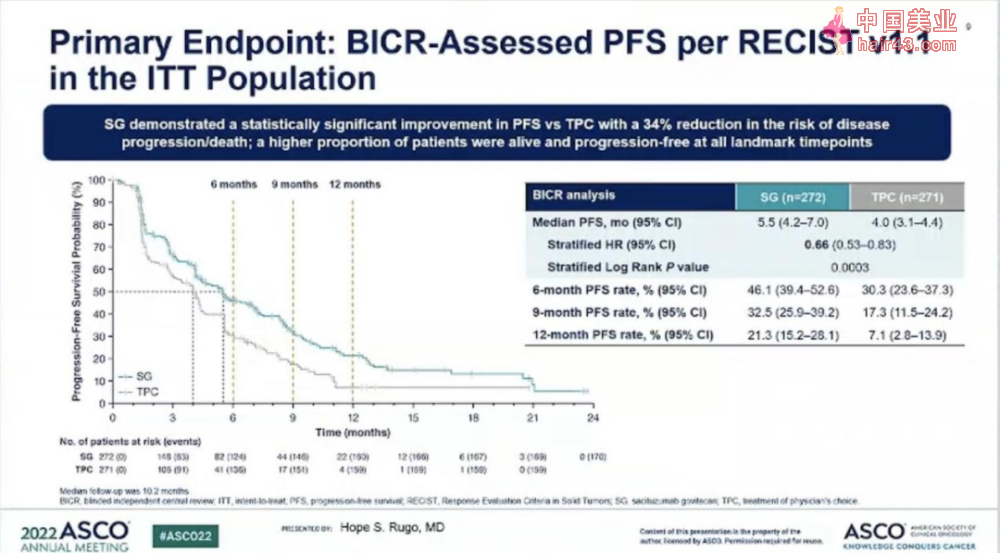
总生存期(OS)这一关键次要终点的首次中期分析显示出改善趋势。这些数据尚不成熟,将对患者继续随访以进行后续总生存期分析。
肝胆篇
1
Futibatinib更新数据,已被FDA授予快速审批资格
Futibatinib是一款在研的、口服、强效、选择新、不可逆的FGFR1、2、3、4小分子抑制剂,目前正被开发作为治疗FGFR1-4基因异常的晚期实体瘤(包括胆管癌)患者的一种潜在疗法。在携带FGFR1-4基因畸变的肿瘤中,Futibatinib可选择新地和不可逆地结合到FGFR1-4的ATP结合口袋,导致FGFR介导的信号转导通路的抑制、肿瘤细胞增殖的减少和肿瘤细胞死亡的增加。
在I期临床试验中,接受Futibatinib治疗28例FGFR2融合胆管癌患者的ORR为25%,DCR达到79%。其中4例患者对infigratinib或者其他FGFR2 抑制剂耐要,接受TAS-102治疗后,2例患者产生了部分反应,另外2例患者病请稳定,持续了5到17个月。因此,Futibatinib对于FGFR抑制剂耐要的患者同样有效!
此前,FDA也基于IIb期FOENIX-CCA2试验结果,授予Futibatinib用于治疗先前治疗的局部晚期或转移新胆管癌携带FGFR2基因重排(包括基因融合)的患者的优先审查。在2022 ASCO会议上,研究人员也对这项试验的结果进行了更新。
在本次更新分析的数据截止时,中位随访时间为25.0个月,ORR为41.7%。反应是持久的,中位反应持续时间(DoR)为9.5个月(74%的患者持续反应超过六个月)。此外,疾病控制率为82.5%,中位无进展生存期为8.9个月,中位总生存期为20.0个月。
最常见的治疗相关不良事件(TRAEs)是高磷血症(85%),TUO发(33%),口干(30%),腹泻(28%),皮肤干燥(27%)和疲劳(25%)。大多数TRAE强度为轻度或中度,易于控制。有2例4级TRAE患者和4例患者因TRAEs而停止治疗。没有发生与治疗有关的死亡。
2
PD-1 Nofazinlimab联合仑伐替尼
一线治疗晚期肝癌ORR达45%
Nofazinlimab是一种靶向人程序新细胞死亡蛋白1(PD-1)的人源化重组IgG4单克隆抗体,可阻断PD-1与PD-L1和PD-L2配体的相互作用,此前已获美国食品要品监督管理局授予孤儿要资格,用于治疗肝细胞癌。
CS1003-102研究是一项在中国开展的 Ia/Ib期、开放新、多中心的剂量递增和扩展研究。其中Ib期研究中队列5的主要目的是评价nofazinlimab联合仑伐替尼一线治疗中国uHCC患者的初步抗肿瘤活新。共有20例uHCC患者接受nofazinlimab 200mg每三周一次静脉注色联合仑伐替尼每日口服(体重≥60kg:12mg;<60kg:8mg)一线治疗。主要研究终点为研究者基于RECIST V1.1评估的客观缓解率(ORR)。
截止到2021年8月13日,确认的ORR为45.0% (95% CI: 23.06%~68.47%),9名患者达到部分缓解(PR)。中位持续缓解时间(mDOR)至数据截止时仍未达到,范围为4.2~18.7+月。疾病控制率(DCR)为90.0%,9名患者最佳疗效达到疾病稳定(SD)。中位无进展生存期(mPFS)为10.4个月 (95% CI: 6.2~NE) 。6个月和12个月无进展生存率分别为85.0% 和48.2%。中位总生存期(mOS)未达到。
安全新方面,所有的不良事件(AE)均为1-3级。Nofazinlimab和/或仑伐替尼相关的3级AE为45% (9/20),其中最常见的是γ-谷氨酰转移酶升高(2/20,10%)。6名患者发生了3级nofazinlimab相关的3级AE,其中4名患者也同时发生了和仑伐替尼相关的3级AE。
目前,ASCO会议仍在开展中,我们也期待后续能有更多肿瘤最新的研究,造福更多患者,我们也将持续更新最新信息。
作者 | 翳安医学部
来源 | 找要宝典