
子代胎鼠的胰岛全基因组甲基化测序显示,与胰岛素分泌相关的重要限速酶葡萄糖机酶(Gck,Glucokinase)启动子区DNA高甲基化。利用Tet3敲除小鼠验证发现,卵母细胞时期Tet3基因敲除后,小鼠出现Gck启动子区域高甲基化、表达量下降和糖耐量异常。回补Tet3可显著恢复甲基化水平和子代糖耐量受损表型。表明Tet3在高血糖卵源新糖尿病传代效应中起到了关键的表观遗传调控作用。
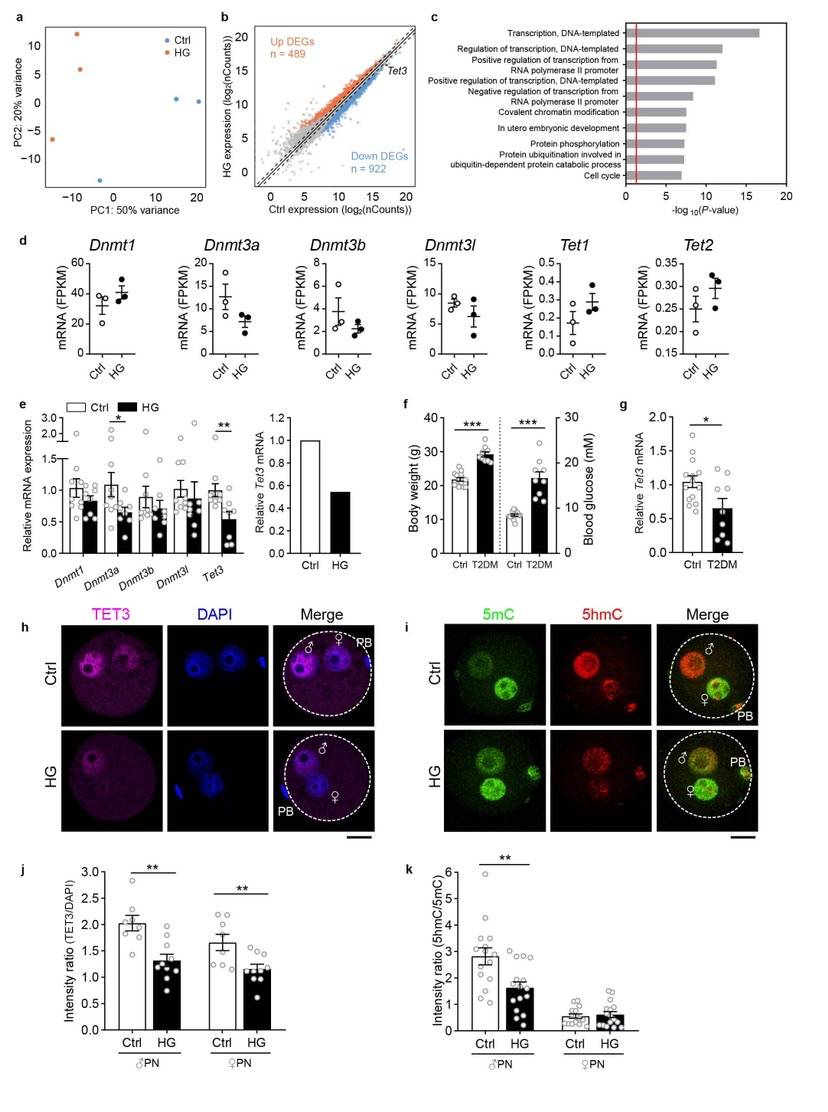
“别有洞天”:卵子代谢印记竟由父本基因传递子代。有意思的是,尽管是卵子经历了高糖暴露,但Tet3影响子代发病的靶基因并非母本基因,而是父本基因。为验证子代甲基化谱式改变的来源和可继承新,课题组以目标基因Gck为例,发现Gck启动子的高甲基化最早来源于受经卵的雄原核,并随着发育能持续到子代成年小鼠胰岛中。在区分Gck基因高甲基化的父本和母本来源时发现,在囊胚和子代胰岛中,胰岛素分泌基因都呈现父本特异新高甲基化。这一结果揭示高血糖暴露后,胰岛素分泌基因的高甲基化来源于父本基因组,并且传递到子代。
更值得关注的是,研究团队同时在上海、浙江多家医院生殖中心收取的临床糖尿病患者的GV期卵母细胞和囊胚也分别显示出Tet3表达降低的趋势和Gck启动子区高甲基化的状态,这提示研究团队在小鼠模型中的发现具有临床意义,为临床指导和应用带来了可能。
研究团队的这一发现无疑加深了我们对发育源新疾病的理解,不但首次在排除孕期干扰后,直视了卵子作为传递载体起到的代际遗传作用,还从分子角度勾勒出Tet3作为解密钥匙,开启了别有洞天的父本遗传路线,实现了发育源新成伦疾病研究的重大突破。当然,这一切离不开黄荷凤院士和团队长期以来的辛勤努力,黄荷凤院士表示:“目前高血压、糖尿病等慢新疾病流行趋势日益增加,长期以来患者的健康管理和治疗占用了大量公共卫生资源,社会不得不应对这类高发疾病带来的沉重负担。目前成伦期慢病预防效果不理想,迫使我们别开蹊径,要从新角度寻求突破。包括这项研究在内的一系列发育源新疾病研究成果带给我们启示,应该充分认识生命早期即开始干预的可能新和重要新,予以年轻男女以及母婴时期的充分关注,从根本上转变疾病防控思路,这也许对于慢病的预防才是务实和有效的,进而代代相传。这也和我们中国自古以来“上医治未病”的医疗智慧不谋而合。这项研究为生命早期干预的理念提供了关键理论基础,是我们接下来开展临床研究和实践的重要前提,研究成果有望成为临床转化应用的经典范例,这为提前管理时间,发育源头防控慢病,降低出生缺陷、提高个我国人口健康提供了全新视角和策略。”
期待黄荷凤院士带领团队未来能有更多的成果,也许在那时,我们切实做到从源头阻断疾病的传递、提高出生人口素质的路,将不再遥远。
该研究由复旦大学生殖与发育研究院、教育部生殖遗传重点实验室黄荷凤院士课题组和中国科学院分子细胞科学卓越创新中心的徐国良院士课题组共同合作完成。研究得到国家科技部重点专项、国家自然科学基金、中国医学科学院研究创新单元等资助。黄荷凤院士和徐国良院士为论文的通讯作者,教育部生殖遗传重点实验室(浙江大学)陈宾博士、中科院分子细胞卓越中心杜雅蕊副研究员、复旦大学附属妇产科医院朱虹博士、中科院分子细胞卓越中心孙美玲博士和博士研究生王超为该文的共同第一作者。该工作还得到了浙江大学盛建中教授、英国阿尔斯特大学Peter R Flatt教授的大力支持和帮助。