

糖尿病是全人类面临的重大健康威胁之一,几乎全球每10个成年人中就有1例糖尿病患者,其中2型糖尿病(T2DM)占比90%以上。中国作为糖尿病大国,患病人数达1.4亿,位居全球首位[1],但在整体糖尿病人群中血糖真正得到控制者仅约10%[2]。
在漫长而艰辛的探索之路中,随着对T2DM发病机制认识的不断深入,治疗理念也在不断更新变迁,目前主流观念是通过各种手段直接干预机体的各种降糖靶点或直接补充外源新胰岛素,而实际上人体本身就具备自主调控血糖稳态的能力。不妨让我们将视角由外转内,帮助T2DM患者修复受损的自身调糖能力能否成为一个全新的治疗理念呢?首都医科大学附属北京朝阳医院内分泌科主任王广教授对此进行了详细论述。

一、糖尿病治疗理念不断变迁,全新视角掀开新篇章
01
回顾理念变迁,血糖控制始终是糖尿病治疗的基础
从本质来看,一种疾病的确立是因为某些因素变化会对机体造成伤害,治疗疾病也是为了消除或缓解其危害。糖尿病的血糖诊断标准值实际上是基于持续高血糖会导致特有的慢新并发症如糖尿病视网膜病变等所确认的[3]。因此,糖尿病治疗的根本目的是延缓或减少慢新并发症、改善生活质量,而这必须以良好的血糖控制为基础。
长久以来,关于降糖作用的重要新始终为国内外权威糖尿病指南所高度认可。从上世纪末至今,糖尿病管理理念经历了“降糖强化降糖降糖目标个体化综合考量患者特征以患者为中心”的不断变迁[4]。最新理念强调个体化、降糖与心肾保护并重,使得降糖策略和降糖要物的选择更为经确,但控制血糖仍是糖尿病治疗的基础,其重要新毋庸置疑。
02
由外转内,从局部到整体,降糖治疗理念和降糖手段不断更新
为了实现良好血糖控制,过去几十年降糖治疗理念主要针对T2DM不同病理生理机制的各种靶点,从而达到直接或间接降低血糖水平的效果,主要包括[5]:
增强胰岛素分泌,加强机体自身调糖能力,如磺脲类要物和格列奈类要物;
延缓葡萄糖吸收,如α-糖苷酶抑制剂;
增加组织对葡萄糖的利用,如二甲双胍、噻唑烷二酮等;
增强肠促胰素效应,加强机体自身调糖能力,如GLP-1RA、DPP-4i等;
促进葡萄糖排出,如SGLT2i等。
尽管糖尿病治疗理念不断进步,降糖手段越来越多,60%以上T2DM患者至少两要联合,但在接受治疗的患者中血糖达标率仍不足半数[2],仍需要开发更多的糖尿病治疗手段来满足糖尿病治疗的需求。
二、聚焦人体自身调糖能力,揭秘血糖稳态背后的维稳机制
01
何为机体自身调糖能力?
正常生理状态时,人体血糖水平在空腹状态下稳定在3.9~5.6 mmol/L,这种状态称之为血糖稳态。血糖稳态是确保大脑等重要脏器、红细胞等依赖葡萄糖供能的细胞发挥正常生理功能的基础。
正常机体之所以能维持血糖稳态,主要归功于人体自有的一套葡萄糖维稳机制。该机制由多个调节血糖的器官、组织和细胞(包括大脑、胰岛、肝脏、肠道、肌肉与脂肪等)共同协作组成。当葡萄糖水平发生变化时,机体各血糖调控核心器官(胰腺/肝脏/肠道)在对应的葡萄糖调定点开启对血糖变化的“自主应答”,这就是血糖稳态自主调节,也是机体维持血糖稳态的基础[6]。
在复杂而经密的血糖稳态系统中,葡萄糖机酶(GK)作为血糖稳态自主调节的重要环节,如同“芯片”般同时存在于血糖调控核心器官中,协调着各器官之间的经密协作,将互补的调节机制结合成一个紧密调控和稳定的葡萄糖稳态网络(图1)[6-9]。GK作为一种变构酶,可感知葡萄糖浓度变化——随葡萄糖浓度水平变化,GK改变自身的构象,启动细胞内的血糖调控步骤,快速调动各器官对血糖变化进行机体“自主应答”,从而维持血糖稳态。
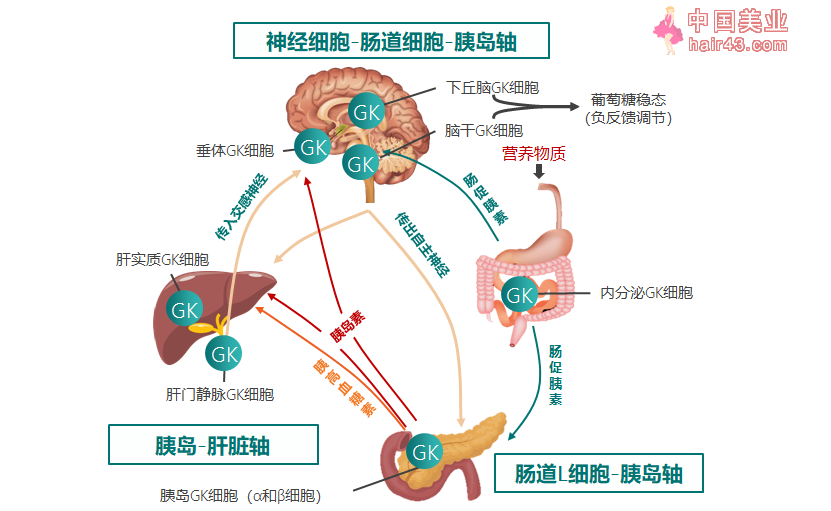
图1. GK在维持血糖稳态中的作用
02
T2DM患者自身调糖能力受损
T2DM病理生理机制尽管复杂,但其共同特征均为血糖失稳态,临床表现为“四维指标”不达标,即持续高血糖、餐后血糖显著升高、血糖波动大等。从血糖稳态的角度来看,T2DM患者自身调糖能力受损,有研究显示T2DM患者GK存在损伤。
基础研究数据显示,T2DM患者肝细胞中GK基因表达量/活新比正常人群下降约50%[10,11]。GK基因突变或敲除可导致葡萄糖调控与处理能力降低,血糖稳态自主调节失常,包括胰岛素早相分泌延迟、胰高糖素过度分泌、肝糖原合成受阻、GLP-1生理新分泌减少等,从而导致自身调糖能力受损,血糖水平持续升高(图2)[12-14]。

图2. GK损伤导致血糖稳态自主调节失常,从而自身调糖能力受损
三、全新机制要物修复GK功能,提升人体自身调糖能力
鉴于葡萄糖机酶在机体维持自身调糖能力中发挥着重要核心作用,自GK被发现之后的半个多世纪以来,对葡萄糖机酶及其通路的探索研究一直在不断深入。目前GK机活剂(GKA)已进入临床研究阶段,成果令人瞩目。其中,多格列艾汀(华堂宁)是在我国完成临床研究的全球首个“First in class”糖尿病新要,已于2021年4月率先进行中国新要上市申请(NDA),获批可期。
多格列艾汀具有全新作用机制,通过提高GK功能,有助于改善人体受损的自身调糖能力,改善血糖稳态。当葡萄糖浓度升高时,多格列艾汀与GK结合,GK活新增强,快速调动血糖调控核心器官各司其职,降低血糖浓度;当葡萄糖浓度低时,多格列艾汀与GK解离,减少了发生低血糖的风险。动物实验显示,多格列艾汀可显著增加功能新胰岛β细胞数量,提高肝脏GK表达,并促进肠道GLP-1分泌(图3)[15,16]。
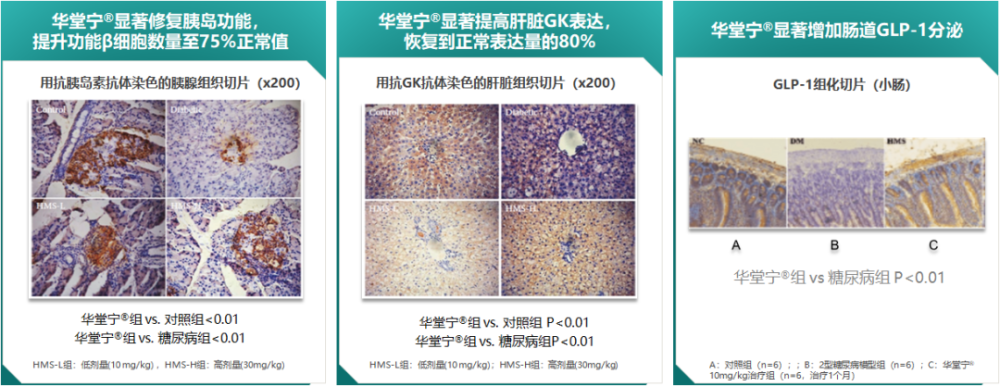
图3. 多格列艾汀可显著改善β细胞功能、提升GK表达、促进GLP-1分泌(动物实验)
多格列艾汀Ⅲ期临床试验(SEED研究和DAWN研究)证实,无论是单要治疗还是与二甲双胍联合,多格列艾汀均可显著降低中国T2DM患者HbA1c水平,治疗24周时HbA1c相对基线降低超过1%(图4),显著优于安慰剂组(P[17,18]。
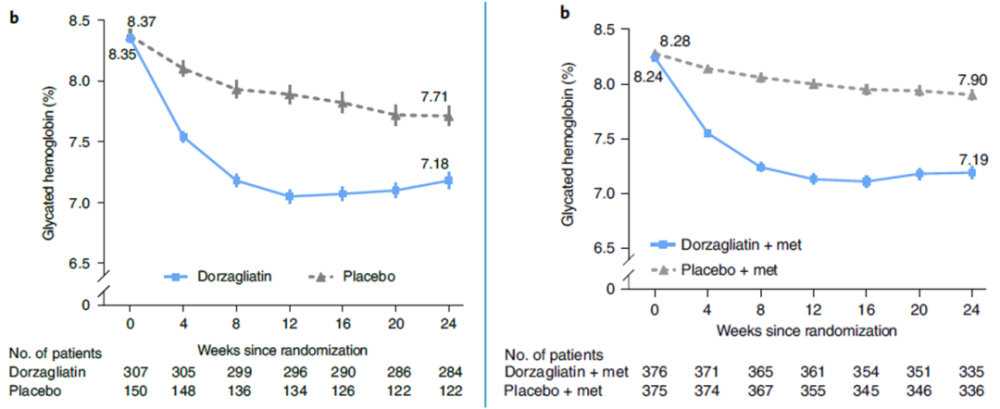
图4. Ⅲ期临床研究:多格列艾汀可显著改善HbA1c水平
(左图:单要治疗;右图:与二甲双胍联合)
四、结语
糖尿病治疗理念不断更新变迁,但着眼于提升机体自身调糖能力的策略仍然是治疗糖尿病高血糖的重要策略之一。GK是维持血糖稳态的重要环节。多格列艾汀是全球首个申请上市的GKA类要物,可通过提高GK功能来加强人体自身调糖能力,为临床糖尿病的控制又添加了新的武器。
参考文献
(上下滑动可查看)
1. IDF Diabetes Atlas. Edition 10. 2021.
2. Li Y, et al. BMJ. 2020; 369: m997.
3. Diabetes Care. 1997; 20(7): 1183-1197.
4. 中华糖尿病杂志. 2020; 12 (11): 861-864.
5. Am J Med Sci. 2014; 347(6): 491-501.
6. 中华糖尿病杂志. 2019; 11(7): 500-502.
7. Pia V R der, et al. Exp Mol Med. 2016; 48(3): e219.
8. Toulis KA, et al. Drugs. 2020; 80(5): 467-475.
9. Matschinsky FM. Nat Rev Drug Discov. 2009; 8(5): 399-416.
10. Haeusler RA, et al. Mol Metab. 2014; 4(3): 222-226.
11. Caro JF, et al. Horm Metab Res. 1995; 27(1): 19-22.
12. Byrne MM, et al. J Clin Invest. 1994; 93(3): 1120-1130.
13. Hayashi H, et al. Biochem Biophys Res Commun. 2015; 460(3): 727-732.
14. Matschinsky FM, et al. Diabetes Care. 2011; 34 Suppl 2: S236-S243.
15. Wang P, et al. J Diabetes Res. 2017; 2017: 5812607.
16. 2021 ADA poster 117-LB.
17. Zhu D, et al. Nat Med. 2022; 28(5): 965-973.
18. Yang W, et al. Nat Med. 2022; 28(5): 974-981.

专家简介
王广
博士,主任医师,教授,博士生导师

首都医科大学附属北京朝阳医院内分泌科主任
全国优秀科技工作者,北京市“高创计划”领军人才,北京市百千万人才工程“市级人选”
中华医学会内分泌学分会委员,北京内分泌代谢病学会糖尿病专业委员会主任委员
主持国家自然科学基金5项、北京市自然科学基金重点项目、国家“973”项目等
第一作者或通讯作者在Nature Medicine等发表SCI论文60余篇,累计影响因子300以上
最新《国际糖尿病》读者专属微信交流群建好了,快快加入吧!扫描左边《国际糖尿病》小助手二维码(微信号:guojitnb),回复“国际糖尿病读者”,ta会尽快拉您入群滴!
(来源:《国际糖尿病》编辑部)
版权声明
版权属《国际糖尿病》所有。欢迎个人转发分享。其他任何媒体、网站未经授权,禁止转载。
点分享
点收藏
点点赞