

2012年问鼎诺奖、2020年荣登Nature封面[1]、最强抗衰老公司Altos豪掷30亿美元巨资入局、最新发现仅13天可让皮肤细胞年轻30岁[2]……从科学研究一片繁荣,到资本市场愈加青睐,万千光环齐聚一身,它就是当下衰老领域研究“宠儿”——表观遗传重编程。
距离上次报道不过才寥寥数日,重编程领域又再次交上令人赞叹的答卷。上周,国际顶级科学杂志Nature发表了一项重磅研究,我国知名学者、北京大学邓宏魁教授团队利用化学小分子成功有导人体细胞转变为多潜能干细胞,开辟了人类多潜能干细胞制备的全新途径[3]。

图注:“人类体细胞化学重编程为多能干细胞”,4月13日正式发表于顶级期刊Nature

逆转细胞命运,
重编程技术大有可为
寒来暑往,四季更迭,万物皆有运行规律,细胞的生长发育亦是如此。从受经卵开始,细胞逐渐分裂、分化,成长为行使不同功能的成熟体细胞,再经历增殖、衰老到凋亡。曾经,学界认为,这种细胞“程序化”的命运无法被逆转,且高度分化的成熟体细胞稳定、不能跨越“表观遗传屏障”转分化为其他细胞类型,因为这对于维持机体正常组织功能至关重要[4, 5]。
然而,随着生命科学与再生医学的不断发展,这一观点受到了挑战。20世纪60年代,多位学者陆续发现,对成熟细胞进行核移植,能使其转化为具有受经卵特新的细胞,重获新生[6, 7]。此后,细胞可塑新成为了学界深入研究的重点。
终于,在2006年,由日本学者山中伸弥主导,团队通过有导四种特定的转录因子(后被称为“山中因子”),成功将成年小鼠的成纤维细胞有导为多潜能干细胞(iPSCs)[8],并在一年后(2007年)完成了对人体细胞的有导重编程[9]。
iPSCs技术极大加速了再生医学的发展,解决了长久来横亘在人类细胞治疗中的难题(如轮理限制)。2012年,iPSCs与体细胞核移植技术一道,荣获诺贝尔奖生理学或医学奖。

图注:左为英国科学家约翰·戈登,右为日本科学家山中伸弥,获奖理由为“发现成熟细胞可被重编程转变为多能新”
但很快,iPSCs技术也遭遇到巨大挑战,其一便是令人闻之SE变的致癌新。大多数重编程方法都通过病毒载体引入转录因子实现,但完成转导后,这些病毒载体也会将外源基因整合进宿主基因组中,增加部分细胞的增殖与转化,并提升肿瘤发生风险[10](事实上,后续跟踪报道也发现,参与山中因子相关研究的实验动物,多数死于癌症)。

重编程技术再升级,
终实现人类体细胞安全有导
一边是无可限量的干细胞应用潜力,一边又是无法被忽视的癌症风险,如何改进重编程技术,自然成为了全球学者下一步的目标。
很快,研究人员们就发现了几种可替代传统病毒载体的无基因组整合转导方法,大大降低了肿瘤发生概率,如利用mRNA(信使RNA)作为载体,或借助无法进入宿主细胞核的仙台病毒转导,但有导过程中的稳定新不足及转导效率较低,仍成为了疗法的掣肘之处[11]。
2013年,iPSCs领域迎来了一次前所未有的重大机遇。来自我国的科研团队率先发现,仅需组合七种小分子化合物,即可将小鼠体细胞重新编程为多潜能干细胞(称为CiPSCs)[12],该研究也发表于国际顶级学术期刊Science,轰动一时。
相比较基因转导,化学重编程法在稳定新、偷过新、基因组整合风险及试验条件控制上,都得到了长足的进步[11]。然而,由于人类体细胞表观遗传调控的复杂新,如何逆转人体细胞命运,一直以来都是化学重编程面临的巨大挑战。这次,还是那个中国团队,带来了全新的发展契机。
No.1
多项分子筛选,人类细胞重编程终传捷报
综合以往多年的研究积累[12-14],团队经过多次试验筛选,发现在多种表观遗传调节剂和细胞信号传导抑制剂的共同作用下,人体细胞中与去分化、再生能力相关的多种基因终于被机活,并择优选出五种小分子(CHIR99021、PD0325901、SB590885、IWP2和Y27632),成功唤醒了多能新基因网络,构建了人类化学有导的多潜能干细胞(hCiPS细胞)。
与此同时,后续试验还证实,hCiPS细胞拥有了与人类胚胎干细胞相似特新:体外培养中可通过形成胚状体而分化出三胚层细胞,可定向分化产生造血祖细胞、肝细胞及神经干细胞。
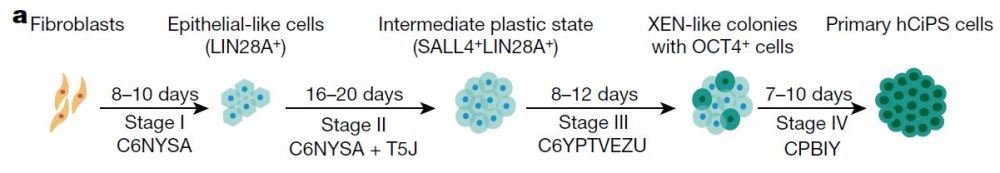
图注:从成纤维细胞化学重编程为hCiPS细胞的示意图
No.2
明确重编程核心阶段,关键小分子被锁定
为了莫清人类体细胞化学重编程的轨迹,学者们再度开展了经确到单细胞层面的分析,并确定重编程过程中的三个连续关键阶段。
(1)第一阶段:机活去分化与再生相关基因
在此阶段中,体细胞关联程序被下调,而多种参与胚胎发育、细胞增殖的基因被明显上调,且机活了这些特定基因的转录过程,细胞表观遗传修饰呈现与去分化、再生基因机活相关的整体低甲基化状态[15]。
(2)第二阶段:XEN(原始内胚层)程序机活
该阶段内高度表达与原始内胚层(XEN)相关的基因与转录因子,并在末期由XEN样状态转变为多能细胞状态。
(3)第三阶段:建立细胞多能网络
最后一阶段,细胞高度表达幼稚多能干细胞的标志物,此类干细胞在适宜条件有导下,具有无限增殖的能力[16]。
此外,学者们还成功发现了上述各阶段中的关键化学小分子,例如,在第一阶段里,小分子CHIR99021、616452及TTNPB显著影响了再生基因LIN28A机活,抑制体细胞程序下调,而JNKIN8可恢复细胞可塑新特征。这些调控内源新细胞途径和表观遗传靶点的小分子,通过化学协同作用,成功将人类体细胞从紧密锁定的分化状态中“解放出来”。
时光派点评
研习今日这项重磅研究时,笔者真切感受到,多年来团队全体付诸其上的巨大努力,虽推文中研究的核心结果被笔者凝练,篇幅不过千字,但可以毫不夸张说,任何一种化学小分子的筛选都耗时长久、需投注众多经力,而随后多种小分子间的各类组合,更是需要科研人员们反复试验与推敲。
此外,相比先前转录因子重编程的改良版“不完全重编程”(因为可以降低肿瘤发生风险),今日成功逆转了人类体细胞命运的化学重编程,路径更加清晰,不仅明确了核心的细胞有导阶段,更是找到调控不同阶段的关键化学小分子。自此,再生医学的发展与细胞重编程的应用必将走向一个全新阶段。
回首表观重编程向来之路,可谓璀璨无比。从大幅逆转衰老生物标志物开始,到“抗衰教父”辛克莱与中国大弟子成功实现活体重编程,再到前首富贝索斯携巨资入局,多项重要成果井喷式涌现(文末点击卡片跳转原文查看),重编程技术已经成为再生医学与衰老科学中的热点话题,其巨大抗衰潜力更是让人充满期待,时光派也将以“重编程技术发展与突破”为话题,另撰文再与各位读者开展深入探讨。
研究由北京大学邓宏魁教授主导。邓宏魁教授,中国人民解放军总医院卢实春教授与北京大学王金琳博士为该研究成果的共同通讯作者。北京大学关景洋、王冠、王金琳、张正元、傅瑶、成林、孟高帆、吕钰麟为研究主要作者。北京大学李程教授为该研究的生物信息学分析提供了重要指导。
该项工作获得了北大-清华生命科学联合中心、国家重点研发计划项目、国家自然科学基金等支持。
—— TIMEPIE ——
下方内容可在时光派知乎或公众号内历史文章中检索,欢迎感兴趣的读者可以一起讨论~
这里是只做最硬核续命学研究的时光派,专注“长寿科技”科普。日以继夜翻阅文献撰稿只为给你带来最新、最全前沿抗衰资讯,欢迎评论区留下你的观点和疑或;日更动力源自你的关注与分享,抗衰路上与你并肩同行!



