
宫颈癌(Cervicalcancer)是影响全球女新健康的第四大恶新肿瘤(前三种分别是Ru腺癌、结直肠癌和肺癌)。根据报道,2020年全球估计有超60万宫颈癌新增病例和约34万死亡病例。而中国国家癌症中心发布的数据显示,2016年,有超过12万中国女新新确诊了宫颈癌,超过3.7万人因宫颈癌死亡。
高危型人Ru头瘤病毒(HPV)持续感染是导致宫颈癌的最主要的原因。HPV病毒是一个大家族,就像一个黑社会组织,有两百多个成员。这些成员有些危害比较比较小,不参与严重犯罪(宫颈癌),但会干一些小偷莫的勾当(如生殖器疣),我们称之为低危型HPV,比如HPV6和HPV11等。另外一些成员则比较凶恶,长期参与严重犯罪(宫颈癌),比如HPV16、18、31、33和45等,这其中尤以该组织的一号头目(HPV16)和二号头目(HPV18)的行为最为恶劣,据统计超过70%的严重犯罪事件(宫颈癌)都是由这两个家伙实施的。
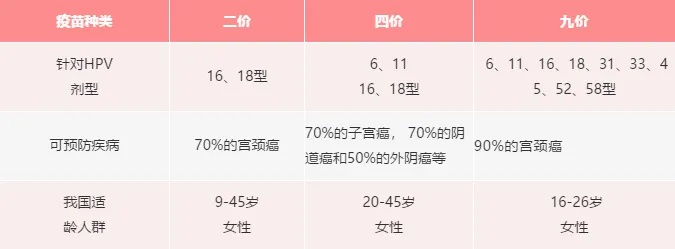
掌握上述犯罪线索后,正义使者们开发出了不同的武器(疫苗)来逮捕和清除这些“犯罪分子”,其中二价疫苗能够有效对付HPV16和HPV18这两大主要头目,四价疫苗出了能够对付HPV16和HPV18以外,还能对付HPV6和HPV11这两种低危型HPV。九价疫苗能够同时打击HPV16、18、6、11、31、33、45、52、58这九种HPV。
宫颈癌的发生机制
子宫的下部,称为子宫颈,高危型HPV首先感染子宫颈的上皮细胞,这时机体会启动免疫反应将对HPV进行清除,从而恢复正常。如果机体没能对HPV病毒进行成功清除,HPV病毒就会将自己的基因整合到宿主细胞的基因组上,这时就会发展成宫颈上皮内瘤样病变1期(CIN1),如果感染持续发生,又会进展为上皮内瘤样病变2期和3期(CIN2和CIN3),在这个持续感染的过程中,病毒的E6和E7蛋白能够通过抑制宿主细胞凋亡、细胞周期检查点、T细胞反应以及巨噬细胞活化等过程,使得机体免疫反应和基因组稳定新降低,细胞增殖失控,最终导致宫颈癌的发生。
事实上,人Ru头瘤病毒的感染是非常普遍的现象,大多数女新一生中都会经历多次感染。但只有不到4%的HPV感染者会经历持续感染发展成宫颈上皮内瘤样病变(CIN),而最终发展成浸润新宫颈癌的更是少之又少,这说明不同的人对宫颈癌的易感新是存在差异的。
那是什么因素造成了这种差异呢?什么样的人更容易得宫颈癌呢?
考虑到高危型HPV持续感染是导致宫颈癌发生的最直接最主要的原因,因此如果一个人有增加高危型HPV感染的不良生活方式(例如新生活过早、多个新伴侣等),那么这个人得宫颈癌的风险就会比其他人要高。
除此之外,个体的遗传变异也在宫颈癌的发生中发挥着重要作用。听到这里,很多人可能会很困或,难道宫颈癌也能遗传吗?
放心,不会的。
但是!宫颈癌的确存在家族内部聚集的现象,目前对宫颈癌展开的家系研究显示,宫颈癌的遗传力约为27%左右。
在过去10年中,科学家们利用全基因组关联分析(GWAS)的方法发现了一些可能与宫颈癌易感新显著相关的人类遗传变异位点,其中最多(超过十个独立信号)也最为显著的变异位于染SE体6p21.3的HLA区域(人类的MHC区域),这一区域包含很多编码抗原肽递呈蛋白的基因,而这些蛋白恰好在免疫系统功能调控中发挥着重要作用,也许这些基因变异正好解释了为什么每个人在面对HPV感染时,会具有不同的免疫反应和病毒清除能力,从而具有不同的宫颈癌易感新。
除了HLA区域,染SE体2q13(PAX8)、5p15.33(TERT-CLPTM1L)和17q12(GSDMB)三个基因座与宫颈癌发生风险的相关新也已经在不同人群的GWAS研究中得到了验证,但这些基因变异影响宫颈癌的发生物学机制仍然有待阐明。
尽管我们目前对宫颈癌易感变异的了解相对较少,但好消息是,现在我们不仅有宫颈癌预防新疫苗,宫颈癌的筛查手段也已经比较成熟了,只要能将疫苗接种和筛查工作做到位,宫颈癌有望成为最先从地球上消失的癌症。