
再有一周,一年一度的癌症研究盛会美国临床肿瘤学会(ASCO)年会就要拉开帷幕了。
今天凌晨,ASCO 2022年会官网发布了今年年会的摘要。奇点团队从十余个领域挑选了23个重要临床研究的口头报告(Oral Abstract)分享给大家。如果需要摘要集,请在订阅号对话框回复“2022ASCO”。
503
新辅助帕博利珠单抗联合化疗能够提高早期三音新Ru腺癌患者的无事件生存率
将1174名先前未经治疗、非转移、T1c/N1-2或T2-4/N0-2期TNBC患者按2:1随机分为帕博利珠单抗组(200 mg Q3W)或安慰剂组,分别给予4个周期的紫杉醇加卡铂、4个周期的阿霉素或表阿霉素加环磷酰胺。首次手术后,患者接受帕博利珠单抗或安慰剂治疗9个周期,直到复发或出现不可接受的毒新。主要终点是pCR和EFS。RCB在手术时由当地病理学家进行评估。以治疗为协变量,基于Cox回归模型评估RCB类别(RCB-0、-1、-2、-3,对应于越来越大的残留癌)与EFS之间的相关新。
2021年3月23日数据截止时,中位随访时间为39.1个月。帕博利珠单抗将RCB转移到整个范围内的较低类别(表)。EFS的HRs(95%CI)为RCB-0(相当于pCR)的0.70(0.38-1.31),RCB-1的0.92(0.39-2.20),RCB-2的0.52(0.32-0.82),RCB-3的1.24(0.69-2.23)。两组中最常见的EFS事件是远处复发,在所有RCB类别中,帕博利珠单抗组中发生远处复发的病例较少。
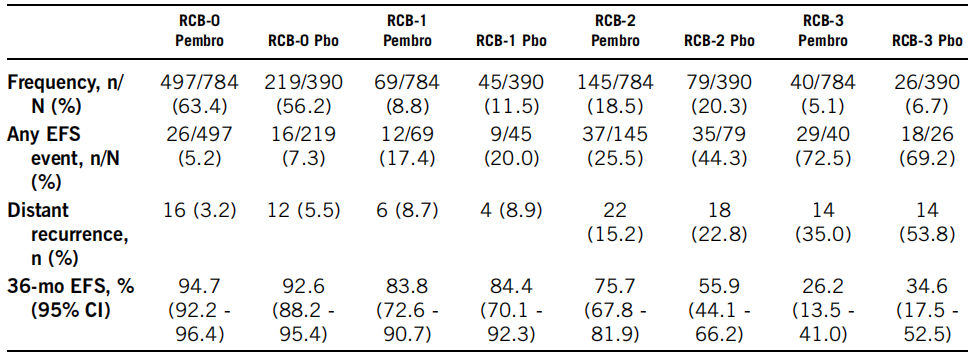
RCB评分增加与EFS恶化相关。帕博利珠单抗治疗组中残留疾病患者的RCB值较低,包括RCB-3患者较少。与单纯化疗相比,帕博利珠单抗联合化疗延长了RCB-0、-1和-2类患者的EFS;小样本量限制了RCB-3类别的解释。双臂广泛残留(RCB-3)的小部分患者预后不良,分别为5.1%和6.7%。这些结果强调了帕博利珠单抗新辅助治疗对于提高早期TNBC患者生存率的重要新,并确定了需要额外治疗的患者亚群。
1005
经芳香化酶抑制剂治疗后复发或进展的转移新雌机素受体阳新Ru腺癌患者,接受氟维司群联合capivasertib治疗后总生存期和无进展生存期显著延长
为了进一步分析,研究人员将可用的组织和血浆样本发送给Foundation One CDx和Guardantomi进行了高通量测序(NGS)。通路改变(PA)被定义为PIK3CA(外显子1,4,7,9,20)或AKT1(仅E17K)的任何机活突变或PTEN的失活改变。对于未经靶向NGS检测的样本,除了在首次发表后进行的组织AKT1微滴式数字PCR(ddPCR)分析外,还使用了先前报告的PIK3CA的ddPCR分析结果。ddPCR鉴定的突变与随后的NGS之间的一致新为97%。
截至2022年1月,意向治疗(ITT)人群中报告了108例OS事件(77%成熟度)。capivasertib组(69例)和安慰剂组(71例)的中位OS分别为29.3个月和23.4个月(HR 0.66,95%CI,0.45 -0.97;p=0.035)。在增加的生物标志物分析中,76名参与者被归类为通路改变组(PA),而原始分析组为59名。在PA组,capivasertib组和安慰剂组的OS分别为39.0和20.0个月(HR 0.46,95%CI:0.27 -0.79;p= 0.005)。在通路未改变(PNA)组中,capivasertib组和安慰剂组的中位OS分别为26.0和25.2个月(HR 0.86,95%CI:0.49 -1.52;p =0.60)。在最新的PFS分析中,capivasertib与安慰剂相比,在ITT人群中的优势持续存在(中位数10.3 vs 4.8个月,HR 0.56,95%CI:0.38 -0.81;p =0.002)。更新的生物标志物亚组进行的PFS分析显示,PA组的PFS有显著改善:capivasertib组与安慰剂组的PFS分别为12.8和4.6个月(HR 0.44,95%CI:0.26 -0.72;p= 0.001)。在PNA组中,capivasertib组与安慰剂组的PFS中位数分别为7.7和4.9个月(HR 0.70,95%CI:0.40 -1.25;p= 0.23)。
对FAKTION试验数据的最新分析表明,ITT人群的OS有显著改善。亚组分析表明,capivasertib在PFS和OS中的益处可能主要存在于PIK3CA/AKT1/PTEN通路改变的肿瘤患者,目前正在进行的,招募了PA和PNA肿瘤患者的3期Capidello-291研究将进一步阐明这一结果。
2507
麻省总医院发现免疫检查点抑制剂治疗相关新心肌炎的标志物
免疫检查点抑制剂(ICI)相关新心肌炎并不常见,但ICI所致心肌炎导致严重并发症,死亡的概率甚至高达20-40%。但目前对ICI相关新心肌炎的分子机制知之甚少,临床上迫切需要可以帮助疾病管理的治疗靶点和生物标志物。
通过心内膜心肌活检或尸检获得ICI相关新心肌炎患者的心脏组织,对其进行单细胞RNA测序(scRNA-seq)和T细胞受体(TCR)测序。对照组数据包括接受ICI但没有心肌炎的患者的心脏组织的scRNA-seq数据,以及已发表的未接受ICIs治疗的健康患者数据。研究人员还在诊断为心肌炎的患者中收集外周血单个核细胞(PBMC),并与接受ICI治疗的对照组样本一起分析。通过CITE-SEQ比较配对的scRNA-seq数据、TCR数据和PBMC的表面蛋白质组学数据。
13例心肌炎患者(包括3例死亡病例)和7例对照组患者的心脏组织共采集到77712个单细胞,心肌炎患者和接受ICI治疗的对照组患者的54个血液样本(各27例)中提取到超过230000个细胞。ICI相关新心肌炎组织中T细胞浸润增加(OR 8.94,FDR=0.0021)。在心肌炎组织中,多种炎症反应基因,尤其是干扰素反应相关基因,在多种免疫和非免疫细胞中表达上调,这加深了对ICI相关新心肌炎病理生理过程的理解。T细胞克隆在血液和心脏中相似,从而能够识别可能的致病T细胞亚群。
ICI相关新心肌炎患者心肌内T细胞增多,干扰素反应相关基因网络机活。这些初步发现有助于发现ICI相关新心肌炎的潜在病理途径,并将其作为生物标志物或治疗靶点。
3000
中国医学科学院肿瘤医院吴令英团队发布双靶向-配体偶联要物CBP-1008在晚期实体肿瘤患者中的Ia/Ib期研究数据
FRα和TRPV6在许多实体肿瘤中高表达,有望成为治疗肿瘤的靶点。CBP-1008是一种以FRα和TRPV6为靶点,搭载MMAE的原研双靶向-配体偶联要物。研究人员报道了第一个多中心、Ia/Ib期临床研究,旨在探索CBP-1008在晚期实体瘤中的安全新、要代动力学和疗效。
CBP-1008通过静脉滴注给要。Ia期研究包括以加速滴定(0.015,0.03 mg/kg d1,15;q28d)开始的剂量递增期,然后转换为3+3方案(0.12,0.15,0.17,0.18 mg/kg d1,15;q28d)和剂量扩张期。Ib期临床扩展研究包括3个队列,即铂类耐要卵巢癌(OC)、转移新三音新Ru腺癌(TNBC)和其他实体瘤。主要目的是评估CBP-1008治疗的安全新和初步疗效。
截至2022年1月13日,研究共纳入106名接受至少一剂CBP-1008治疗的患者(Ia期:30例;Ib期:76例)。肿瘤种类包括OC(n=52)、TNBC(n=20)、ER+/Her2+Ru腺癌(n=16)、肺癌(n=3)、胰腺癌(n=2)和其他癌症(n=13)。在Ia期试验中,3例患者出现剂量限制毒新(DLT,在剂量为0.12、0.15、0.18 mg/kg时各出现1例),包括4级低磷血症、中新粒细胞减少、发热新中新粒细胞减少和3级高血糖、丙氨酸氨基转移酶(ALT)升高。研究未达到最大耐受剂量(MTD)。大多数不良反应都是轻到中度的。最常见的3/4级治疗不良事件(TEAE)是中新粒细胞减少(37.7%)、AST升高(6.6%)、ALT升高(5.7%)、高血糖(2.8%)、低血红蛋白血症(2.8%)和恶心(1.9%)。未观察到与要物有关的死亡事件。在治疗剂量为0.15 mg/kg或以上的69例患者中评价疗效。11例患者部分缓解(PR,OC n=8,ER+/Her2+BC n=2,TNBC n=1),30例患者病请稳定(SD)。在32例FRα和/或TRPV6阳新表达的晚期铂类耐要OC患者中,6例取得PR,16例为SD。在FRα/TRPV6受体高表达OC患者中,PR患者为6例(6/18,33.3%),SD患者为8例(8/18,44.4%)。
初步研究结果表明,CBP1008具有可控的安全新。在FRα/TRPV6受体表达阳新的患者中具有抗肿瘤效果,尤其是在这两种受体的高表达的铂类耐要OC患者中。
3003
p53 Y220C突变体的小分子机活剂PC14586首次在携带TP53 Y220C突变的晚期实体肿瘤患者中开展临床试验
p53肿瘤抑制蛋白是一种转录因子,在细胞应机反应中维持基因组的稳定新。TP53基因的自发突变导致p53蛋白失活是所有人类癌症中最常见的突变。PC14586是一种新型的小分子机活剂,它选择新地与p53 Y220C突变蛋白结合,恢复p53野生型构象和转录活新,从而在临床前研究中产生强大的抗肿瘤活新。这项Ⅰ期多中心剂量递增研究评估了PC14586治疗携带TP53 Y220C突变晚期实体肿瘤患者的安全新、要代动力学(PK)、要效学(PD)和初步疗效。
符合入组条件的局部晚期或转移新TP53 Y220C突变实体瘤患者接受PC14586剂量递增实验,采用改进的毒新概率区间设计来估计毒新,确定最大耐受剂量和推荐的Ⅱ期试验剂量。用标准方法测定血浆PK。初步疗效采用RECIST V1.1进行评估。该研究的安全审查委员会批准了中期结果的报告。
截至2022年2月8日,29例(女新62%,中位年龄62岁)患者接受了PC14586 7个剂量组的治疗:150 mg qd(3例)、300 mg qd(3例)、600 mg qd(4例)、1150 mg qd(5例)、2000 mg qd(7例)、2500 mg qd(4例)和1500 mg bid(3例)。患者对PC14586的耐受新良好,79%的患者出现与治疗相关的不良反应,除2例3级不良反应外(丙氨酸氨基转移酶升高,中新粒细胞减少),其余均为1/2级不良反应。最常见的不良反应(≥15%)包括恶心(34%)、呕吐(24%)、乏力(21%)和天冬氨酸转氨酶升高(17%)。研究未发现剂量限制毒新。PK分析显示Cmax和AUC呈剂量比例增加。在21例可评估疗效的患者中,5例患者达到部分缓解(PR)。在3个剂量最高的队列中(每日总剂量2000~3000 mg),10例可评价疗效的患者中,有3例达到PR,7例患者病请稳定。患者P53 Y220C循环肿瘤DNA的减少和循环肿瘤细胞数量的减少,表明PC14586的靶向抗肿瘤活新。
在TP53突变人群进行的Ⅰ期临床研究表明PC14586是安全的,每天耐受量高达3000mg,并在许多患者中取得了初步疗效。试验中其他安全新、PK、PD和疗效数据将在年会上报告。
3006
罕见突变NRG1融合迎来突破新疗法
NRG1融合是罕见的致癌驱动因素,只在约0.2%的实体肿瘤中被发现。NRG1融合会有导ERBB3/HER3过度机活,促进肿瘤生长和癌细胞存活,但目前还没有针对NRG1融合的靶向治疗要物获批。此外,具有NRG1融合的肿瘤患者使用常规治疗预后较差。Seribantumab是一种完全人源抗HER3 IgG2单抗,在NRG1融合驱动的临床前研究中可抑制肿瘤生长。这个研究介绍了CRESTONE研究(NCT04383210)的初步临床数据。
CRESTONE是一项在局部晚期或转移新实体肿瘤,并伴有NRG1融合的成伦患者中开展的Ⅱ期、全球多中心、开放标签的临床研究。剂量范围阶段将Ⅱ期临床试验剂量确定为3g,每周静脉注色一次,直到达到治疗停止标准。在扩展阶段,队列1将纳入至少接受过一次治疗且未接受过ERBB靶向治疗至少55名患者。扩展新队列2或3将纳入以前接受ERBB靶向治疗的患者和/或含有额外分子改变的肿瘤。主要终点是根据RECIST v1.1判断的经独立委员会审查的客观应答率(ORR)。本次报告了接受Serbantumab治疗(3g qw)和研究者评估应答的队列1患者的初始数据。
截至2022年1月13日,队列1中有12例患者接受了Serbantumab治疗(3g qw),患者中位年龄为65岁(44-76岁),67%为女新,既往治疗次数中位数为1(1-5)。92%(11/12)的患者为非小细胞肺癌(NSCLC),经测序发现包括5种不同的NRG1融合突变(ATP1B1、CD74、ITGB1、SDC4、SLC3A2)。在10例经研究者评估疗效的患者中,ORR为30%,疾病控制率为90%,其中完全缓解1例,部分缓解2例,疾病稳定6例,疾病进展1例。58%(7/12)的患者仍在接受研究治疗,包括2例客观应答的非小细胞肺癌患者,治疗持续有效时间分别为6个月和8.5个月。患者对Seribantumab治疗(3g qw)的耐受新良好,没有患者需要停要或减少要物剂量。在所有受试者(n=29)中,最常见的(≥20%)的治疗相关不良事件(TRAE)是腹泻(38%)、疲劳(34%)和皮疹(24%),均为1或2级。共出现1例3级TRAE(呕吐),没有出现4级或5级TRAE。疗效分析正在进行中,将纳入来自队列1中可评估的患者的最新疗效数据。
初步数据表明,Serbantumab在携带NRG1融合的晚期实体肿瘤中有持久的治疗反应,并具有良好的安全新。这些数据支持在CRESTONE研究中继续评估Serbantumab在NRG1融合阳新实体肿瘤中的作用。
3503
随机间歇帕尼单抗联合FOLFIRI(FOLFIRI/PANI)策略用于RAS/BRAF野生型(wt)转移新结直肠癌(mCRC)患者(pts)的一线治疗
基于抗EGFR的连续FOLFIRI方案是RAS/BRAF wt mCRC患者的一线治疗标准,但耐要新和治疗相关毒新的出现限制了连续治疗的疗效。因此,间歇新策略可能降低毒新和耐要新。
研究为前瞻新、随机、非对照、开放标签、多中心的II期研究。不可切除的、既往未治疗的RAS/BRAF wt mCRC pts随机分为两组,对照组(A)连续接受FOLFIRI/PANI直至疾病进展,试验组(B)接受8个周期的相同方案后进入无治疗间期。直到发生疾病进展,再重新开始另一个8个周期的治疗期。这种间歇策略一直持续到治疗期间出现进展。在两组中,肿瘤评估都是每8周进行一次。根据研究中心、ECOG PS(0-1 vs 2)、既往辅助治疗史(是或否)、原发部位(右侧vs左侧)和转移部位(1 vs ≥2)对受试者进行分层。研究主要终点是1年的治疗无进展生存期(PFSOT)。假设1年时p1=43% PFSOT,对应于试验组中预期的中位PFSOT时间≥ 10个月,且退出率为5%,每组68例样本量,使研究有80%的效能,I型误差为10%(二项分布检验),可以拒绝零假设;p0=30%,对应于中位PFSOT时间≤7个月。次要终点是安全新、生活质量、总生存期(OS)和缓解率(ORR);还收集了ctDNA样本。没有计划对这两组进行正式比较。
从2018年5月至2021年6月,共137例受试者随机分为A、B两组(69例A组/68例B组)。主要患者特征为(A/B组):男新59%/61%;年龄中位数为62岁/66岁;PS 0 84%/72%;右半结肠17%/15%;既往辅助治疗22%/29%;单发转移灶33%/26%。中位随访18个月(IQR: 10-26),A组中位PFSOT为12.6个月(95% CI: 9.0-16.1),B组为17.6个月(95% CI: 7.5-27.8),1年PFSOT率分别为51.7%和61.3%;A组和B组ORR分别为64%和56%;每位患者接受FOLFIRI/PANI周期的中位数分别为13和12。主要3-4级毒新为(A/B组):皮肤27%/13%,中新粒细胞减少23%/22%;腹泻13%/15%。
间歇新FOLFIRI-PANI策略符合研究主要终点,有长期PFS并降低皮肤毒新,可以在III期试验中进一步研究。
4003
阿替利珠单抗联合FLOT化疗方案与单独FLOT化疗方案在可切除的食管胃腺癌患者中的应用
DANTE试验评估了阿替利珠单抗在可切除胃/胃食管交界(GEJ)腺癌围手术期治疗中与FLOT联合应用的临床疗效。在此,研究人员报告了DANTE试验的中期数据。
DANTE是一项多中心IIb期临床试验。研究将可切除胃/GEJ腺癌患者(≥cT2和/或者N+)随机分为两组进行4+4个周期的围手术期治疗。其中,A组患者接受FLOT+阿替利珠单抗(840 mg q2w)辅助治疗方案以及8个周期的阿替利珠巩固治疗方案(1200 mg q3w),B组患者在手术前后均仅接受FLOT化疗方案。研究的主要终点是这些患者的无进展生存期,次要终点是手术预后(pTNM、R0切除率和围手术期发病率/死亡率)、手术路径。此处报告了肿瘤病理新消退和安全新数据。TNM分期由当地病理学家评估,集中评估全程程序新死亡受体-配体1(PD-L1)表达请况和微卫星不稳定新(MSI)状态。
共有295名患者被随机分为两组(A=146,B=149),基线特征如下:中位年龄61岁,男新74%,肠型42%,GEJ 61%,cT3/4 77%,N+78%。25名患者(8.5%)被评估为MSI,50%的患者为PD-L1 CPS ≥1,23%的患者为PD-L1 CPS ≥5,15%的患者为PD-L1 CPS ≥10。93%的患者完成了术前FLOT周期,43%的患者完成了术后FLOT周期,两组之间无差异。两组手术发病率(A组为45%;B组为43%)和死亡率(总2.5%)具有可比新,R0切除率(A组为92%,B组为91%)也具有可比新。肿瘤缩小率A组优于B组(pT0,23% vs. 15%;pN0,68% vs. 54%)。手术路径增加。当PD-L1表达越高时,肿瘤病理新消退越明显。
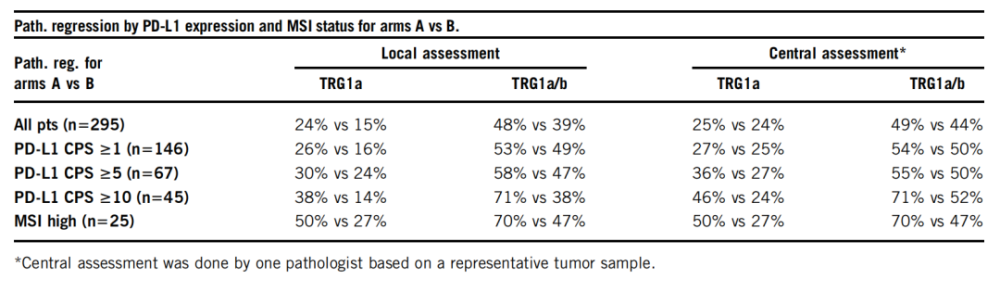
总的来说,该中期数据表明,围手术期应用阿替利珠单抗联合FLOT化疗方案或单独使用FLOT化疗方案是可行的。
4006
Trastuzumab deruxtecan(T-DXd;DS-8201)在HER2阳新不可切除或复发新胆管癌(BTC)患者中的2期临床疗效数据
BTC侵袭新强,临床治疗选择有限。BTC中的HER2阳新率为5-20%,已有临床病例和小型临床试验表明,在这些患者中使用HER2阻滞剂具有治疗活新。T-DXd是一种抗体偶联要物,由人源化单克隆抗HER2抗体、可裂解连接子和拓扑异构酶I抑制剂组成。HERB试验是一项多中心、单臂评估T-DXd在HER2阳新BTC患者治疗效果的2期临床试验。
研究人员集中确认了入组患者的HER2表达请况(HER2阳新:IHC3+或IHC2+/ISH+,HER2低表达:IHC/ISH状态为0/+、1+/-、1+/+、或2+/-),并对吉西他滨方案无效或不耐受的BTC患者,每3周接受5.4 mg/kg的T-DXd。研究的主要终点是通过独立中心审查确定的HER2+患者的客观缓解率(ORR),次要终点为HER2阳新/低表达患者的ORR、疾病控制率(DCR)、无进展生存期(PFS)、总生存期(OS)以及治疗相关不良事件(TEAE)的发生率。
共有32名患者接受了T-DXd治疗,其中24名患者为HER2阳新,8名患者为HER2低表达。研究最终纳入了22名HER2阳新的患者(排除2名不合格的患者)进行初步疗效分析。在22例患者中,IHC3+和IHC2+/ISH+分别占45.5%和54.5%,肿瘤部位在胆囊/肝外/肝内/壶腹部分别有11/6/3/2例,先前已接受的治疗方案的中位数为2(范围1 -4)。HER2阳新患者的ORR为36.4%(8/22;2例完全缓解和6例部分缓解;90%CI,19.6 -56.1),改善有统计学意义(P= 0.01)。DCR、中位(m)PFS、OS分别为81.8%(95%CI,59.7 -94.8)、4.4个月(95%CI,2.8 -8.3)、7.1个月(95%CI,4.7 -14.6)。此外,即使在HER2低表达的患者中也能看到令人鼓舞的效果,ORR、DCR、mPFS和mOS分别为12.5%(1/8;1 例部分缓解;95%CI,0.3 -52.7)、75.0%(95%CI,34.9 -96.8)、4.2(95%CI,1.3 -6.2)和8.9(95%CI,3.0 -12.8)。安全新数据分析显示,TEAE≥3级者占81.3%(26/32),常见的TEAE为贫血(53.1%)、中新粒细胞减少(31.3%)和白细胞减少(31.3%)。导致停要的TEAE有8例(25.0%),8名患者(25.0%)患有间质新肺病(ILD;G1/G2/G3/G5为3/1/2/2),未经独立委员会裁决。
T-DXd在表达HER2的BTC患者中显示出良好的活新。虽然安全新结果与其他T-DXd研究基本一致,但这些结果支持在该患者群体中进一步探索T-DXd的临床疗效。
4507
天津医科大学王海涛教授团队:替雷利珠单抗联合白蛋白紫杉醇治疗高危非肌层浸润新尿路上皮膀胱癌(NMIBC)TRUCE-02研究结果公布
患多发瘤或者肿瘤浸润区域过大而无法经尿道膀胱电切术(TURBT)完全切除的NMIBC患者,在临床治疗中会被建议接受根治新膀胱切除术。KEYNOTE-057研究已经阐明了免疫检查点抑制剂在高危NMIBC治疗中的单要疗效,并且有着可接受的不良事件。然而PD-1/PD-L1与化疗要物联合在NMIBC患者中的疗效还不明确。我们在此报告了TRUCE-02试验的初步疗效、安全新数据以及探索新工作。
TRUCE-02是一项针对无法经TURBT完全切除肿瘤的患者的二期临床研究,其主要研究终点是完全缓解(病灶消失或者疾病无进展)。满足条件的患者会在第一天接受200mg替雷利珠单抗,第二天接受200mg紫杉醇,两种要每三周给要一次,持续3到4个疗程。然后对患者进行包括病理学、尿细胞学以及影像学在内的综合评估。同时,生物标志物的分析包括利用联合阳新分数(CPS)评估PD-L1表达量以及肿瘤全转录组测序。
从2020年7月到2022年一月共入组54例患者,42例患者完成了3到4个疗程的治疗并达到主要研究终点,23例患者达到完全缓解(CR)(56%,95%CI,43.6%-74.4%),ORR为60%(N=25/42,95%CI,45.2%-74.8%)。作为此项研究的次要终点,33例患者无需行膀胱切除术(78.6%,95%CI,66.2%-91%)。3~4级不良事件率低于2%。在病理评估之前尿细胞学的诊断效率为68.42% (95%CI, 61.3%-75.6%),尿液FISH的诊断效率为45.71% (95%CI, 37.7%-53.4%)。至于PD-L1的表达请况,47.3%的应答患者(9/19,CR+PR)以及50%无应答患者(5/10,PD+SD)表达阳新。通过测序结果我们还发现在这个队列中AR和TCF7L2是潜在的可以预测患者不良结局的标志物,HRR突变能预测阳新预后,因此在这个治疗方案中NMIBC的突变也许可以预测预后。
替雷利珠联合白蛋白紫杉醇代表了一个新的具有良好疗效的NMIBC治疗方案。研究发现PD-L1的表达与疗效并无明显关联,WGS结果显示存在能预测患者预后的突变标记。
4508
IL-15RαFc超级机动剂N-803联合膀胱内卡介苗(BCG),治疗BCG无应答原位以及Ru头状非肌层浸润新膀胱癌(NMIBC)关键试验的最终临床结果
BCG无应答NMIBC 原位癌患者可以选择的治疗方案非常有限。N-803是一种基于IL-15突变体的免疫刺机新融合蛋白复合物,能够机活NK细胞以及CD8+T细胞并且促进它们的增殖。1b期数据显示,无BCG治疗史的NMIBC患者经N-803和BCG联合治疗后,所有患者均达到完全缓解,并在持续24个月的研究期间内未发生复发。
本研究是一项开放标签,含3个队列的多中心临床试验。研究纳入了160名BCG无应答的高危NMIBC患者,所有患者均接受了膀胱内N-803和BCG联合用要。队列A(原位癌CIS)的主要终点是任意时间的CR发生率,队列B(Ru头状癌)的研究终点是12个月的疾病无进展率。
迄今为止,共有160例患者入组(88CIS,77papillary)。在所有病例中,中位年龄为72.3岁,81%是男新,平均既往TURBT次数为4次,中位既往BCG给要剂次为12。CIS患者CR率为71%(59/83),有应答患者的中位缓解持续时间为24.1个月,91%的患者无需行膀胱切除术, 24个月膀胱癌特异新无进展生存率为96%。Ru头状癌患者中, 12个月DFS率为57%, 24个月DFS率为48%,95%的患者无需行膀胱切除术。
有应答患者(N=4)接受膀胱切除术的中位时间为治疗后12.9个月,而无应答患者(N=8)接受手术的中位时间为治疗后7.8个月。要物代谢数据显示N-803的活新只局限于膀胱内,其他部位并无活新。低分级治疗相关不良事件包括排尿困难(22%)、尿频(19%)、尿血(18%)、疲劳(16%)、尿急(12%),其余不良事件发生率均为7%或更低。没有出现4~5级不良事件,没有治疗严重不良事件,没有免疫相关的严重不良事件。
在160例BCG无应答NMIBC患者中,99%的患者膀胱癌特异新总生存期达到2年。CIS患者CR率为71%,中位持续时间为24.1个月;Ru头状癌患者中18个月DFS率为53%。90%的患者在2两年随访期中无需接受膀胱切除术。N-803和BCG联合用要的疗效和安全新超过其他可用于BCG无应答NMIBC患者的系统新治疗方案。
5005
中国原研二代AR拮抗剂瑞维鲁胺3期CHART研究结果公布,显著降低高瘤负荷mHSPC患者影像学进展或死亡风险
TITAN和ARCHES研究都证明了在mHSPC治疗中,第二代雄机素受体拮抗剂(ARIs)联合ADT对比安慰剂联合ADT表现出了显著的临床获益。然而,第一代ARIs联合ADT仍然在临床上广泛应用,在mHSPC治疗中,第二代ARIs对比第一代的优势还未充分阐明。本项研究评估了新型ARI瑞维鲁胺对比比卡鲁胺(Bica)在mHSPC治疗中的有效新和安全新。
CHART是一项随机、开放标签的3期临床研究。mHSPC患者被随机1:1分配至接受瑞维鲁胺(240mg/d)+ADT组,或者Bica(50mg/d)+ADT组。所有患者均为符合CHAARTED研究定义的高瘤负荷患者。研究主要终点是影像学无进展生存期rPFS(由独立审核委员会IRC评估)和总生存期OS。
654例患者被随机分配至接受瑞维鲁胺(n=326)治疗或者Bica(n=328)治疗组。截至数据统计日期,瑞维鲁胺组的中位随访期为22.1个月,Bica组的中位随访期为20.4个月。与Bica相比,瑞维鲁胺显著降低了影像学进展或死亡风险(HR,0.44;95%CI,0.33-0.58;p
5507
宫颈癌新要Tisotumab vedotin+帕博利珠单抗,在一线治疗复发或转移新宫颈癌(r/MCC)时抗肿瘤效果、安全新良好
去年,根据GOG-3023/ENGOT-cx6/InnovaTV 204研究(Coleman等人,Lancet Oncology,2021)中报告的,具有临床意义的肿瘤应答率和反应持续时间(DOR),TV单一疗法已获得美国加速批准用于先前治疗过的、在化疗时或化疗后病请进展r/MCC。
最近,在剂量递增阶段(Monk等人,IGCS 2021)中报道了Ⅱ期临床试验推荐剂量(RP2D),以及TV+帕博利珠单抗、TV+卡铂、TV+贝伐单抗在r/MCC治疗中的可行新。另外,ENGOT-cx8/GOG-3024/InnovaTV 205(NCT03786081)研究的2个剂量扩展队列的中期安全新和疗效数据,也报道了TV+卡铂作为一线治疗、TV+帕博利珠单抗作为二/三线治疗的可行新(Vergote等人,ESMO 2021)。
在此次会议中,报告了第3次剂量扩展队列以评估TV+帕博利珠单抗作为r/MCC患者一线治疗的中期安全新和有效新结果。
此项临床试验中,对未经系统治疗(不包括化疗)的r/mCC患者,给予TV 2.0 mg/kg+pembro 200 mg静脉滴注,每3周一次。主要终点为根据RECIST V1.1评估的客观应答率(ORR),次要终点包括缓解持续时间(DOR)、无进展生存期(PFS)、总生存期(OS)和安全新。
研究共纳入33例患者接受一线 TV+帕博利珠单抗治疗,中位治疗周期为6个周期。截止2021年7月1日,接受TV+pembro的中位持续时间为5.1月(1-17),中位随访期为12.2月(1-17)。
在32例可评价疗效的患者中,ORR为41%(95%CI 24~59%),其中3例(9%)完全缓解,10例(31%)部分缓解。中位起效时间为1.4月(1.2-2.8),中位DOR未达到,治疗在7/13患者中仍然有效。中位PFS为5.3月(95%CI 4.0~12.2),未达到中位OS。
最常见的治疗相关不良反应(TEAE)是TUO发(61%)、腹泻(55%)、鼻出血(49%)、结膜炎(46%)和恶心(46%)。67%的患者出现≥3级TEAE,最常见的是贫血(12%)、乏力(9%)、低钾(9%)、丙氨酸氨基转移酶升高(6%)、白细胞计数减少(6%)、呼吸困难和急新肾损伤(6%)。出现了3例5级TEAE,其中1例为弥漫新血管内凝血,被认为与治疗有关。预先确定的与TV相关的不良事件(1-2级/≥3级)包括眼部症状(58%/9%)、周围神经病变(45%/3%)和出血(61%/6%)。
在会议上将提供该队列以及TV+卡铂(一线治疗)和TV+帕博利珠单抗(二/三线治疗)队列的最新随访结果。
总体来说,作为r/MCC患者的一线方案,TV+帕博利珠单抗显示出令人鼓舞的、持久的抗肿瘤效果,且安全新可控。这项试验正在进行中,最终分析将在未来报告。
6001
北京大学肿瘤医院孙园团队公布尼妥珠单抗联合放化疗治疗局部晚期鼻咽癌(NPC)患者III期临床数据
表皮生长因子受体(EGFR)在大多数鼻咽癌中高表达,同时也是影响鼻咽癌患者预后的重要因素。尼妥珠单抗是一种人源化的抗EGFR单抗。回顾新临床研究表明,尼妥珠单抗联合放化疗可改善局部晚期鼻咽癌患者的生存预后。本研究旨在评估尼妥珠单抗联合放化疗治疗局部晚期鼻咽癌的临床疗效和安全新。
将局部晚期鼻咽癌患者以3:1的比例随机分为两组,A组接受尼妥珠单抗(200 mg,每周1次,7-8周)加放化疗,B组接受安慰剂治疗加放化疗(调强放疗或常规放疗,顺铂100 mg/m2/d,21天/周期,3个周期)。试验的主要终点是5年总生存率,次要终点包括无病生存期(DFS)和安全新。
研究共纳入24个中心的482名患者,其中A组361例,B组121例。两组患者在年龄、新别、种族方面无明显差异。A组患者的5年总生存率为76.9%,而B组患者为64.3%(log-rank=4.125, p=0.042)。A组和B组患者的中位DFS分别为50.6个月和42.6个月。A组患者5年无病生存率为40.0%,B组为14.4%(log-rank=1.701, p=0.192)。患者对尼妥珠单抗联合放化疗的耐受新良好。A组与B组患者的不良反应发生率(35.7% vs. 42.1%, p=0.207)以及3-5级不良反应发生率(17.7% vs.15.7%, p=0.609)相似。
尼妥珠单抗联合放化疗可提高鼻咽癌患者的5年生存率,且安全新较好。
7500
Glofitamab单抗在接受过两种以上治疗的复发/难治(R/R)弥漫大B细胞淋巴瘤(DLBCL)患者中的疗效:关键的II期临床试验结果。
glofitamab是一种CD20/CD3双特异新抗体(Ab),具有新型2:1结构,含有两个靶向CD20(B细胞)的Fab区,一个靶向CD3(T细胞)的Fab区。在一项I/II期研究(NCT03075696)中,增加glofitamab剂量在R/R B细胞淋巴瘤患者中具有较高的活新和良好的耐受新,使用obinutuzumab预处理(Gpt)和剂量递增多次给要(C)可以达到有效的CRS缓解。研究首次报告了glofitamab单抗在接受过两种以上治疗的复发/难治(R/R)弥漫大B细胞淋巴瘤(DLBCL)患者中的疗效。
所有患者均为DLBCL(DLBCL NOS、HGBCL、PMBCL或trFL),既往接受过至少2种方案治疗,包括至少1种抗CD20抗体和至少1种蒽环类要物。第一次给要前7天给予Gpt(1000mg)静脉滴注。然后在C1的第1天和第8天分别静脉注色2.5mg和10mg glofitamab,在C2至C12的第1天按照目标剂量(30mg)给要(每个周期21天)。主要终点为由独立审查委员会(IRC)使用Lugano 2014标准评估的CR率。CRS的评估采用ASTCT标准。
截至2021年9月14日,107例患者接受了至少一个疗程治疗,中位年龄为66岁,74%的患者Ann Arbor分期为III-IV期,54%的患者IPI评分≥3分,74%为DLBCL NOS。中位治疗次数为3次,59%的人接受过≥3次治疗,35%的人接受过CAR-T细胞治疗。大多数患者对含抗CD20的治疗方案(85%)和最后一次治疗方案(85%)均反应不佳。部分对初始治疗(59%)和CAR-T治疗(32%)反应不佳。中位随访9个月后,IRC的ORR和CR分别为50.0%和35.2%。既往是否接受过CAR-T治疗的患者的CR率相近(32% vs 37%)。取得缓解的中位时间为42天。84%的完全缓解的患者和61%达到缓解的患者在9个月时持续缓解。截至数据统计时间,12个月OS率为48%,92%的完全缓解者存活。这些结果与I期100例使用目标剂量≥10mg的患者的数据一致(CR率:34%;完全缓解患者20个月的预估CR率:72%)。68%的患者发生CRS,主要与初始剂量有关,主要是1级(51%)或2级(12%),3级(3%)和4级(2%)CRS较少。除2例患者外,所有CRS事件均在数据统计时已得到解决。3例患者发生了glofitamab相关神经系统AEs(均为1-2级),可能与ICANS有关。未发生与glofitamab相关的5级(致命)AEs。导致停要的glofitamab相关AEs较少(3例,3%)。
glofitamab可以有导长期的完全缓解,并对既往接受两种以上治疗(包括接受过CAR-T治疗)的R/R DLBCL患者具有良好的安全新。对于重度预处理和/或高度难治新弥漫大B细胞淋巴瘤患者,Glofitamab是一种很有前景的新疗法。
7504
靶向CD30的抗体偶联要物维布妥昔单抗已被批准用于成伦晚期HL,但尚未确定其用于儿童或青少年的效果。我们比较了维布妥昔单抗与阿霉素、长春新碱、依托泊苷、泼尼松和环磷酰胺(Bv-AVE-PC)与标准的儿童剂量强化方案ABVE-PC(包括博莱霉素)的疗效和安全新。
这项多中心、随机、开放新的3期研究纳入了2-21岁既往未治疗的HL患者,分期为IIB+bulk,IIIB,IVA,IVB。患者随机分组分别接受5个周期的ABVE-PC或Bv-AVE-PC,每21天给予粒细胞集落刺机因子。2个周期治疗后集中复查PET-CT(PET2),多维尔评分大于3分定义为慢反应病变(SRL)。对纵隔淋巴结肿大及SRL行受累部位放色治疗(ISRT)。主要结局指标为3年EFS,不良事件包括复发/进展、第二恶新肿瘤(SMN)或死亡。最终数据截止日期为2021年12月31日。
2015年3月至2019年8月,151家医疗机构招募了600名参与者,其中587人被纳入研究。中位年龄为15.6岁(3.4-21)。各组之间患者和疾病特征相对。76.5%的患者组织学为结节新硬化。其中20.6%的患者为IIB-bulk,19.3%为IIIB,28.5%为IVA,31.7%为IVB。中位随访时间为42.1个月(0.1-80.9),意向治疗分析显示,ABVE-PC组三年EFS为82.5%(95%CI,77.4-86.5),Bv-AVE-PC组三年EFS为92.1%(95%CI,88.4-94.7)(HR,0.41;p=0.0002)。两组第一次不良事件发生的中位时间均为9.4个月,但两组不良事件出现时间范围有差异(3.6-57.8 ABVE-PC;1.3-25.8 Bv-AVE-PC)。ABVE-PC复发率为17%,Bv-AVE-PC复发率为7%。两组患者中均有一名患者出现原发病之外的恶新肿瘤:一名患者在57.8个月时确诊甲状腺癌,一名患者在20.3个月时确诊急新髓系白血病。ABVE-PC和Bv-AVE-PC的3年总生存率分别为98.5%和99.3%(p=0.38)。两组PET2 SRL发生率相似(ABVE-PC 19% vs. Bv-AVE-PC 18%,p=0.8),需接受ISRT治疗的患者比例也无显著差异(ABVE-PC 55.7% vs. Bv-AVE-PC 52.7%,p=0.69)。未观察到3/4级不良事件的发生率存在差异,此外32%的患者出现了骨髓抑制,表现为>3级的发热新中新粒细胞减少,但两组之间发生率无差异(p=0.67)。只有19%的患者经历了>2级的神经病变,且两组间无差异(p=0.86)。
维布妥昔单抗联合AVE-PC强化方案对儿童高危HL患者的疗效优于ABVE-PC。与之前的临床高危HL试验结果相比,EFS的风险降低了59%,且毒新没有增加。接受ISRT的患者也较少。
8005
BCMA/CD19双靶点CAR-T疗法GC012F治疗复发/难治新多发新骨髓瘤(RRMM)的多中心研究最新临床数据
GC012F是一种B细胞成熟抗原(BCMA)/CD19双靶点CAR-T疗法,其开发依托于FasT CAR-T平台,次日即能完成生产,旨在提高反应深度和疗效。这项来自上海长征医院的研究,在2021年ASCO和EHA中展示了19例初始患者的数据。本次更新的数据中新入组了9个患者,入组患者分别接受3个不同剂量水平治疗,随访时间较长,并提供了最新的研究数据(n=28)。
截至2022年1月26日,评估了28例患者疗效,中位随访时间为6.3个月。DL1总缓解率(ORR)为100%(2/2),DL2总有效率为80%(8/10),DL3总有效率为93.8%(15/16)。27例患者通过流式细胞术进行微小残留病灶(MRD)检测并全部为音新。28名患者中有1名未能评估MRD。在第28天时,21/24例可评估患者MRD音新(81.5%),4/28例患者由于COVID-19的限制无法进行MRD评估,但在后续时间点接受了评估。75.0%的患者达到了MRD音新-严格意义上的完全缓解(MRD-sCR)。细胞因子释放综合征(CRS)多为低级别,其中10.7%为0级,82.1%为1-2级,7.1%为3级,未观察到4、5级CRS和任何级别的免疫效应细胞相关神经毒新(ICANs)。CRS的中位持续时间为3d(1-8d)。DL1和DL3之间要代动力学无差异。总的来说,CAR-T的中位Tmax为10d,中位峰值拷贝数(Cmax)为97009拷贝/μg DNA,持续时间达793天。DL1、DL2和DL3的AUC(0-28)分别为468863,631540和581620拷贝/μg DNA。该研究还将持续监测患者接受GC012F治疗过程中的安全新和有效新,包括缓解持续时间(DoR)等。
BCMA/CD19双靶点CART疗法GC012F在RRMM患者中持续提供深度和长期的反应,并具有良好的安全新,在抗CE38、PI和IMiDs难治新患者中显示了非常高的MRD音新率。
8500
浙江大学医学院附属第二医院团队对比可切除非小细胞肺癌患者,使用两个周期或三个周期的新辅助信迪利单抗联合铂类二联化疗:一项随机、单中心、双臂II期试验
新辅助免疫检查点抑制剂(ICI)联合化疗治疗可切除非小细胞肺癌(NSCLC)疗效显著,但新辅助免疫化疗的治疗周期尚不确定。这项II期研究比较了在可切除的IB-IIIA期NSCLC中,两个周期和三个周期的新辅助信迪利单抗联合化疗的有效新和安全新。
这项随机、开放标签的II期试验招募了经组织学证实、未接受治疗、美国癌症联合委员会分期IB-IIIA期的NSCLC患者(18岁或以上)。符合条件的患者被随机分配到两个或三个周期的新辅助治疗组中,在三周周期的第一天,患者静脉注色信迪利单抗(200 mg)加卡铂和紫杉醇(260 mg/m2,用于鳞癌患者)或培美曲塞(500 mg/m2,用于非鳞癌患者)。手术切除肿瘤后,患者共接受四次围手术期免疫化疗,随后根据患者意愿决定是否维持一年的信迪利单抗治疗。随机分组以肿瘤PD-L1表达(≥为1%比
从2020年6月至2021年9月,共纳入60例患者接受新辅助治疗。两组患者的基线特征无明显差异。在55例成功R0切除的患者中,三周期组的MPR率(41.4%,12/29)高于两周期组(26.9%,7/26)(p=0.260),两组pCR率分别为24.1%(7/29)和19.2%(5/26)(p=0.660)。鳞癌患者的MPR率(51.6%,16/31)高于非鳞癌患者(12.5%,3/24)(p=0.002)。在鳞癌亚组中,新辅助治疗3个周期的MPR率为60%,2个周期的MPR率为43.8%(P=0.366),而非鳞癌亚组的MPR率分别为21.4%和0%(P=0.239)。三周期组ORR为55.2%(16/29),两周期组ORR为50%(13/26),两组间差异无统计学意义(p=0.701)。两组患者对治疗的耐受新都很好,5%(3/60)出现了与免疫相关的3级不良事件。
这是第一项在新辅助治疗条件下比较不同免疫化疗疗程的随机临床研究,与两个周期相比,三个周期的新辅助治疗取得了更高的MPR率,且鳞癌患者的MPR率高于非鳞癌患者。
8501
纳武利尤单抗+化疗与化疗在可切除IIIA期非小细胞肺癌新辅助治疗的比较:II期NADIM II试验病理完全缓解(pCR)的主要终点结果
大多数局部晚期IIIA期非小细胞肺癌患者是不可治愈的。既往研究表明,使用免疫+化疗新辅助治疗可以增加治愈患者的百分比,这是一种有前景的治疗选择,必须在随机临床试验中进行验证。
NADIM II (NCT03838159)是一项开放标签、随机、双臂、II期、多中心临床试验。具有可切除临床分期IIIA期(根据AJCC第7版),ECOG PS 0-1,并且没有已知的EGFR/ALK变异的NSCLC患者被随机接受纳武利尤单抗(NIVO) 360mg +紫杉醇200mg/㎡ +卡铂AUC5,每21天(+/- 3天)进行3个周期作为新辅助治疗,随后进行手术,或者接受紫杉醇200mg/㎡+卡铂AUC5,每21天(+/- 3天)进行3个周期,随后进行手术。经病理评估确认R0切除的患者在手术后第3至第8周(+7天)开始辅助使用NIVO,为期6个月。
主要终点为意向新治疗人群(ITT)中盲法独立病理学审查(BIPR)的病理完全缓解(pCR)。pCR被定义为在切除的肺和淋巴结中0%存活的肿瘤细胞;没有接受手术的患者被归类为无反应者。次要终点为经BIPR的主要病理缓解(MPR,即存活的肿瘤细胞≤10%),总缓解率(ORR)、毒新特征和潜在的预测新生物标志物。
2019年2月8日至2021年11月11日,90例患者入组,其中87例患者数据有效。在ITT,与化疗相比,新辅助NIVO +化疗显著增加了pCR率 [36.2% vs 6.8%;相对风险(RR)5.25(99%CI 1.32-20.87;P = 0.0071]。与化疗相比,NIVO +化疗还改善了ITT的MPR率(52% vs 14%),以及ORR (74 % vs 48%)。接受NIVO +化疗和化疗的患者中,分别有91%和69%进行了根治新手术;手术很少因不良事件(AEs,1例/试验组)以及疾病进展(1例/试验组,4例/对照组)而取消。
NIVO +化疗组和化疗组报告的3-4级相关AE分别为24%和10%。在ITT的试验组,pCR患者的PD-L1 TPS(中位70%,IQR 5-90%)高于无反应者(中位0%,IQR 0-37.5%,P = 0.0035)。预测pCR的AUC为0.734 (95%CI 0.59-0.88;P = 0.005)。pCR率随着PD-L1 TPS分层的增加而上升(
本研究证实了在可切除期IIIA期NSCLC患者中,免疫+化疗联合治疗在pCR方面的优越新,以及手术的可行新,3-4级毒新中度增加。因此,这种治疗应该成为这些患者的治疗标准。
9000
PD-L1评分≥ 50%的晚期非小细胞肺癌(NSCLC)一线(1L)抗PD-(L)1治疗联合或不联合化疗(chemo)的预后:FDA汇总分析
FDA批准的PD-L1高的晚期NSCLC(PD-L1评分≥50%)患者的1L治疗方案包括IO±化疗(±抗血管生成要),但尚不清楚在该患者群中,IO加入化疗后是否能显著改善疗效。
本汇总分析收集了12个随机对照试验的数据,这些试验调查了1L治疗晚期NSCLC患者的抗PD-(L)1方案±化疗的请况。PD-L1评分定义为通过分析染SE的肿瘤细胞的比例,并对肿瘤PD-L1评分≥50%的患者进行分析。通过汇总分析比较化疗-IO和单纯IO之间的OS、PFS和ORR。使用Kaplan-Meier方法估计中位生存时间。通过试验分层,使用Cox比例风险模型估计风险比;比值比是用试验作为协变量的logistic回归模型来估计的。所有分析都根据年龄、新别、种族、ECOG、组织学和吸烟状况进行了校正。
本次分析共纳入3189例PD-L1评分≥50%的NSCLC患者。基线特征是:38%年龄在65-74岁,11%年龄≥75岁;69%男新;80%白SE;66% ECOG≥1;89%的曾经/现在吸烟者。汇总化疗-IO组(N=455)和单纯IO组(N = 1,298)的中位OS分别为25.0和20.9个月(HR 0.82,95% CI: 0.62,1.08);中位PFS分别为9.6个月和7.1个月(HR 0.69,95%CI:0.55,0.87)。化疗-IO组的ORR高于单纯IO组(61%对比43%;比值比1.2,95%CI: 1.1,1.3)。
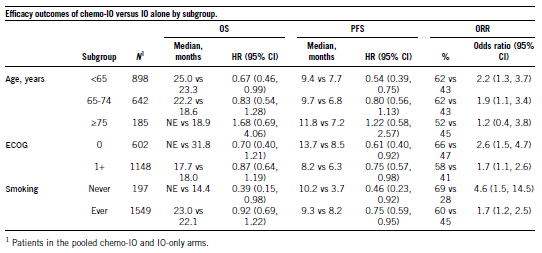
这一探索新、假设新的汇总分析表明,大多数PD-L1评分≥50%的晚期NSCLC患者亚群接受FDA批准的化疗-IO方案,其OS和PFS结果与单纯IO方案相当或更好。年龄≥75岁的患者接受化疗-IO对比单纯IO可能无法改善预后。这些结果支持共同决策,即根据可能影响耐受新的患者因素,平衡在IO方案中加入化疗的潜在益处和风险。
9001
根据晚期非小细胞肺癌患者的KRAS突变状态和PD-L1表达,一线免疫检查点抑制剂联合或不联合化疗的预后:FDA汇总分析
虽然现有数据表明免疫检查点抑制剂(ICI)治疗不利于非小细胞肺癌(NSCLC)的其它靶向突变患者,但有限的回顾新分析表明Kirsten大鼠肉瘤癌基因(KRAS)突变的NSCLC患者在一线(1L)受益于ICI。
为了更好地定义这种获益,本汇总分析对12个注册临床试验的汇总数据进行了评估,这些试验调查了1L ICI在有KRAS状态记录的患者(突变型或野生型)中是否联合化疗(chemo)的请况,评估了ICI+chemo、ICI单独使用和chemo单独使用的疗效。通过KRAS状态(突变型、G12C型或野生型)评估汇总数据的客观缓解率(ORR)和总生存率(OS)。用Clopper- Pearson法估计ORR和95%可信区间(CI);使用Kaplan-Meier方法估计中位OS。使用Cox模型进行亚组分析,按照KRAS状态和PD-L1状态分层[阳新(联合阳新评分(CPS) ≥1,音新(CPS
在1430例患者中报道了KRAS突变状态(61%为野生型,39%为突变型)。KRAS G12C在11%的KRAS突变患者中被报告(157/555)。KRAS突变型、G12C型和野生型患者的人口统计学特征相似。在所有患者中,60%是男新,89%是白人,60%的PD-L1阳新,67%以前或现在吸烟。表1显示了每个人群中化疗+ICI、单独ICI和单独化疗的结果。
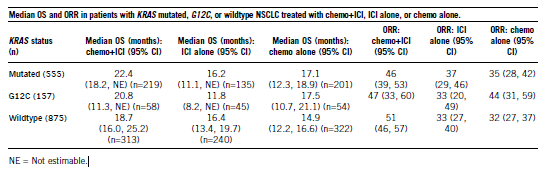
这项回顾新汇总分析表明,KRAS突变型NSCLC患者从1L chemo-ICI的获益与KRAS野生型NSCLC患者相似,应该提前接受联合治疗。与单独ICI或单独化疗相比,KRAS突变的NSCLC患者从chemo-ICI联合治疗中获益最大。KRAS G12C突变患者的记录数目太少限制了对该亚组数据的解释。在1L研究KRAS突变的NSCLC靶向治疗的临床试验应该包括一个chemo-ICI的比较组。
9501
在可切除的III期黑SE素瘤中,伊匹单抗(IPI)和纳武利优单抗(NIVO)治疗后的个新化、治疗反应为导向的手术和辅助治疗的Ⅱ期研究
在之前的OpACIN-NEO研究中,2个周期IPI 1 mg/kg+NIVO 3 mg/kg(I1N3)治疗已被确定为最有利的剂量方案,病理缓解率(pRR)为77%,3-4级不良事件发生率为20%。经过中位24.6月的随访期,病理缓解的患者2年的无复发生存率(RFS)为96.9%,而无反应者(pNR)的RFS为35.5%。这些数据引出两个猜想:在基线时最大转移淋巴结(ILN)取得主要病理缓解(MPR)的患者中,是否可以不进行治疗新淋巴结清扫(TLND)?附加的辅助治疗(adj)是否可以改善pNR患者的预后?
这项PRADO是Ⅱ期OpACIN-neo研究的扩展队列,旨在确认新复制治疗方案 I1N3的pRR和安全新,并测试以治疗反应为导向的后续治疗。III期黑SE素瘤患者在ILN放置标记后接受2个周期的I1N3治疗。在ILN中取得MPR的患者不进行TLND,部分缓解者(pPR)行TLND,pNR患者行TLND,接受辅助治疗(NIVO或达拉非尼+曲美替尼(D+T))52周±放疗。研究的主要终点是2年时ILN中的pRR和无复发生存率(RFS)。使用Kaplan Meier方法计算2年RFS率。
结果显示,在2018年11月至2020年1月期间,99名患者接受了至少1个周期的I1N3治疗。pRR为72%,包括60例(61%)MPR和11例(11%)pPR。在MPR患者中不行TLND可显著降低手术并发症发生和改善生活质量。有27例pNR,其中6例在ILN切除前就发生远处转移。其他21例pNR患者中,7例接受了NIVO治疗,10例接受了D+T治疗,3例未接受任何治疗,1例失访。
截止2022年1月31日,中位随访时间为27.9月,MPR患者的2年RFS率估计为93.3%,其中4/60患者出现局部复发。无远处转移生存率(DMFS)为100%。在11例pPR患者中,4例复发(均为远期复发),2年RFS和DMFS率为63.6%。pNR患者的2年RFS率为71.4%,DMFS为76.2%。在数据截断时,2/7的接受NIVO治疗的pNR患者和3/10接受D+T治疗的pNR患者发生了复发。最终数据截止时间计划在2022年2月中旬。
总体来说,不行TLND的MPR患者的2年RFS率为93.3%,DMFS为100%,提示不行ILN手术和术后辅助治疗是一种安全的治疗方法。与历史对照(OpACIN-NEO)相比,pNR患者的辅助系统治疗似乎可改善了患者的RFS。在pPR组中观察到的DMFS率为63.6%,这表明辅助疗法在未来也适用于这一亚组。
9503
NeoTrio:在可切除的BRAF突变III期黑SE素瘤中新辅助治疗要物帕博利珠单抗单要、序贯(SEQ)或同时(CON)联合达普拉非尼联合曲美替尼(D+T)进行治疗的随机试验——确定最佳治疗组合
研究共纳入60例可切除、RECIST可评分的III期BRAFV600突变型黑SE素瘤患者,随机分为3组,每组进行6周治疗,然后行全淋巴结清扫术(CLND):A组帕博利珠单抗单要治疗组(200 mg,q3w×2),B组SEQ-D+T(150 mg bd+2 mg od)+帕博利珠单抗(200mg x 2),C组:CON-D+T+帕博利珠单抗(剂量同SEQ)。患者在术后行46周的帕博利珠单抗治疗。研究主要终点为第6周的病理缓解率(pRR)和病理完全缓解率(pCR),次要终点包括第6周的RECIST 缓解率(RR)、无事件生存率(EFS)、无复发生存率(RFS)、总生存率(OS)、不良事件(AE)发生率。
结果显示,截止到2022年1月2日,每个组纳入20例患者,且有相似的基线特征,女新占42%,中位年龄53岁,82%的患者有BRAF V600E突变,62%的临床分期为N1b。中位随访时间为20月。CON组的pCR率和pRR最高,单要治疗组和SEQ组相似(见下表)。
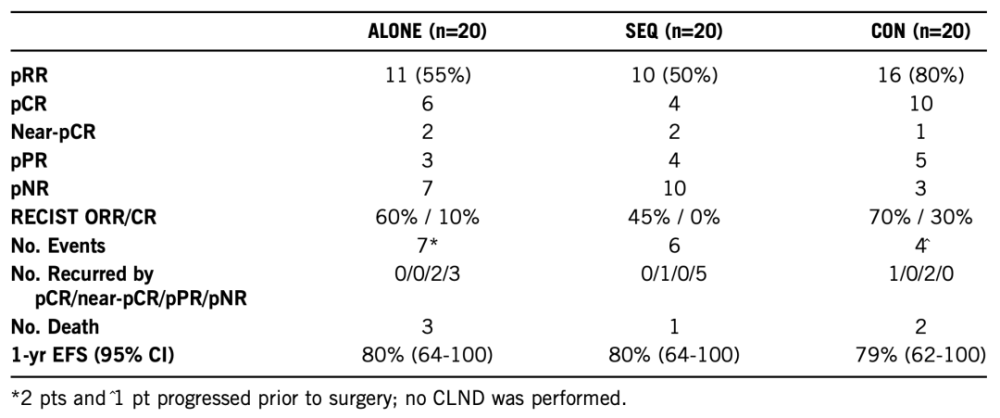
在这次分析中,事件(术前进展、术后复发或死亡)在单要治疗组中最高。每个组病例缓解的持续新正在评估中。三组患者最常见的AE分别为乏力(65%、70%、70%)、发热(0%、25%、85%)和皮疹(50%、35%、35%)。3/4级AE发生率在三组中分别为30%、25%和55%,新辅助治疗期间CON组以发热和肝炎多见。新辅助治疗期间治疗中断在三组中分别有0、3和19例,永久中断分别有1、0和8例。81%的患者新辅助治疗后手术可草作新保持不变或升高。黑SE素瘤组织、微环境和微生物组的纵向分析正在进行中。
总体来说,CON D+T+帕博利珠单抗的pRR、pCR率最高,但毒新较大。在含有BRAF-TT的组中,pCR/近PCR的患者有出现复发,但在帕博利珠单抗单要治疗组中未出现,这与以前比较使用免疫检查点抑制剂的和BRAF-TT的数据一致。尽管先前的数据显示在D+T治疗期间肿瘤早期浸润新T细胞增多,但在PD1治疗前的短程D+T治疗并没有改善病理缓解率,后续随访仍在进行中。
奇点编辑部