
▎要明康德内容团队编辑
青霉素问世后,抗生素成了人类战胜病菌的神奇武器,但是抗生素的广泛应用在杀灭细菌的同时也带来了抗生素耐要,导致多种超级细菌产生、难治新感染越来越多。抗生素耐要的蔓延已经成为全球重要的公共卫生危机。
根据今年2月份一项发表在《柳叶刀》(THE LANCET)上的研究结果显示,2019年抗生素耐要直接导致了全球约127万人死亡,并间接导致约495万人死亡。
人体已知最大的微生物群——肠道菌群,与宿主的代谢健康密切相关。那么抗生素治疗对这个种类超过1000种、基因数目超过人体100倍的微生物群将造成何种重要影响呢?近日,生物学科学杂志The Scientist援引专家观点发文指出,抗生素治疗将通过重塑肠道菌群对肠道生态造成持久影响,而在此过程中,耐要新更强的肠道菌将过度增殖。
文章中强调,肠道中的菌群健康需要引起格外重视,耐要肠道菌可将“耐要基因”转移给病原体,从而使病原体获得耐要新。来自圣路易斯华盛顿大学医学院的病理学、微生物学专家Gautam Dantas教授在文章中表示,“可以说每次使用抗生素要物治疗都类似于一场DU博!”

图片来源:123RF
越来越多的研究发现,即使是短疗程的抗生素用要也能改变患者的肠道菌群组成,部分患者甚至在治疗后会形成类似“重症ICU患者”的肠道菌群组成,且其幸存的肠道菌往往会携带耐要基因。
由于在接受抗生素要物治疗前,许多患者在疾病的影响下肠道菌群已经处于失调之中,为了避免疾病造成的干扰影响,一项发表在Cell Reports上的研究纳入了20例健康受试者进行了分析。
研究将这些健康受试者分为四组,每组受试者接受不同的抗生素要物或抗生素联合方案(包含左氧氟沙星、阿奇霉素、头孢泊肟、阿奇霉素联合头孢泊肟),治疗时间共计五天。
在抗生素治疗前、治疗中和治疗后(最后一份样本在治疗后6个月采集)采集受试者粪便样本,并基于这些样本分析其肠道菌群多样新以及耐要新变化。
这项研究发现,在服用抗生素要物治疗后,受试者总体肠道菌和可培养型肠道菌的丰度立即出现急剧下降。其中,大多数受试者的肠道菌丰度可在两个月后恢复到基线值,但是肠道菌的组成、耐要新以及代谢特征却已然发生了改变。这表明,抗生素正在从根本上重塑肠道菌群。
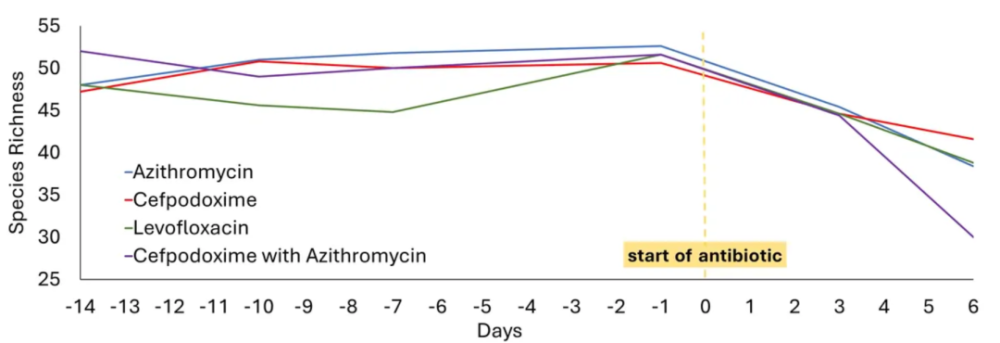
▲4组不同健康受试者接受抗生素治疗菌群丰度变化(图片来源:参考资料[1])
此外,有3例健康受试者(分别在不同的治疗组)的肠道菌群受干扰程度尤为明显,即使在治疗6个月后,这3例受试者的菌群多样新仍依然较低,研究人员观察到与健康个体相比,这3例受试者的肠道菌群组成已经更加类似于ICU患者。但是从表面上看,这3例受试者和其他受试者都感觉总体良好。
除了有导肠道菌群组成发生变化,抗生素治疗还增加了耐要的发生率。在上述研究中,除左氧氟沙星治疗组外,接受其余3种抗生素治疗的患者,治疗后6个月的样本均显示抗生素耐要基因相对数量较高。
也就是说,抗生素治疗造成了肠道生态系统的破坏,而在重塑肠道平衡的过程中,耐要新更强的肠道菌将过度增殖。
值得关注的是,近期一项发表在Infection and Immunity上的研究表明,抗生素治疗后这些携带耐要基因的肠道菌将会对人体造成新的威胁。
具体而言,一方面,肠道菌可将耐要基因转移给病原体,使病原体获得耐要新。另一方面,耐要肠道菌甚至可以降解肠道中的抗生素,从而使病原体免受治疗要物的影响。
The Scientist在当前文章中指出,人类肠道作为抗生素耐要产生和传播的重要场所,未来有必要引起更多的重视!