
▎要明康德内容团队编辑
基因治疗的概念自1972年被提出后,其后50年间,基础研究的发展为患者“从根本上进行疾病治疗”带来了新的希望。同时,新的技术如基因编辑的发展也让“只需一次治疗”越来越成为可能。
眼科疾病是理想的基因治疗候选对象。一方面,得益于眼睛是免疫特权空间,几重血-眼屏障使得眼睛与免疫系统相对独立。另一方面,许多眼部疾病是由于单个或多个基因的缺陷造成的,很多遗传新眼科疾病的突变已经被经准识别,为基因疗法开发提供了众多的靶点选择。
在今天的这篇文章里,要明康德内容团队将结合全球眼科基因疗法的在研管线分析,为您介绍未来1-10年内眼科基因疗法领域有望发生的重大进展。
内容概要
眼科基因疗法未来一年内重要里程碑
未来一年有17款眼科基因疗法有望达到新的里程碑(获批、递交监管申请或推进临床进展等),其中,3款疗法有望达到3期及以后的里程碑
眼科基因疗法未来十年潜在发展方向
眼科疾病患者受益群体扩大:青光眼、单纯孢疹病毒角膜炎等十几种疾病为临床前阶段相对于临床阶段新增适应症,未来这些疾病患者群体有望使用基因疗法进行治疗
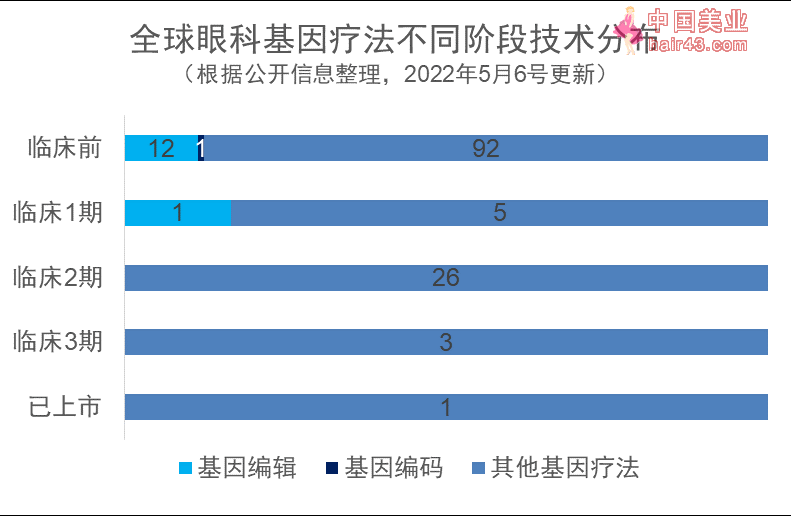
突破基因载荷限制的非病毒载体占比在临床前阶段相比临床阶段占比上升:目前临床阶段管线中非病毒载体数量占比为6%,临床前管线中非病毒载体占比为13%
新技术不断被开发:基因编辑疗法在临床管线中占比为3%,在临床前管线占比为11%,同时新型技术如基因编码(Gene Coding)技术出现
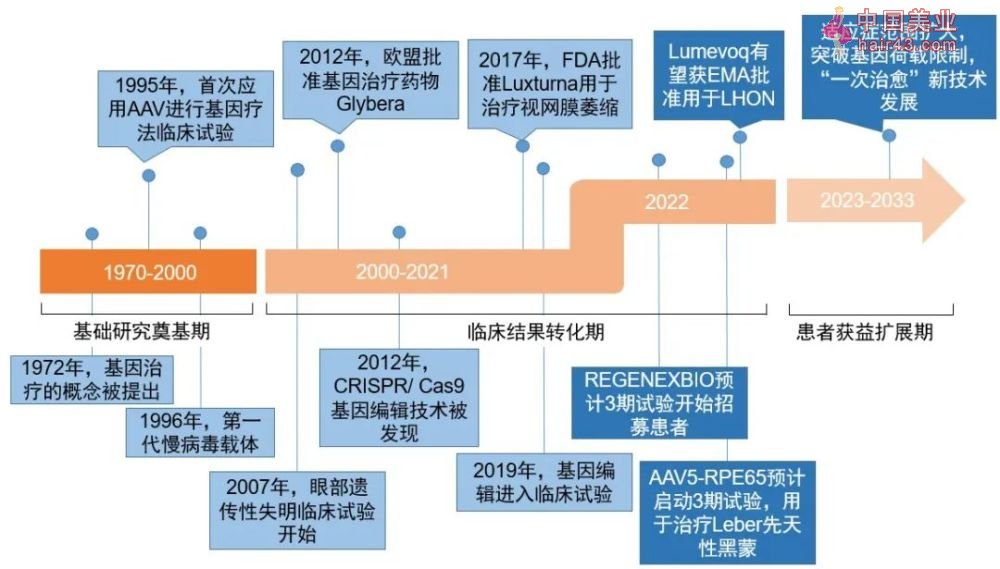
▲眼科基因疗法发展进程(数据来源:参考资料[1-12],要明康德内容团队制图)
眼科基因疗法未来一年内重要里程碑
未来一年内有望达到新里程碑的眼科基因疗法共有17款,其中,GenSight Biologics的Lumevoq有望在今年第三季度完成上市需要的生产批次验证,REGENEXBIO公司的RGX-314的3期临床试验将开始患者招募,MeiraGtx的AAV5-RPE65有望开始进行3期临床试验。
要物名称:Lumevoq
公司名称:GenSight Biologics
适应症:Leber遗传新视神经病变(LHON)

今年1月24日,GenSight Biologics公司宣布,基因疗法Lumevoq(lenadogene nolparvovec)的一项长期随访研究获得积极结果。数据表明,在接受该疗法玻璃体内单次注色治疗4年后,携带ND4基因突变的Leber遗传新视神经病变患者的视力表现出持续的显著改善。4月14日,公司宣布,预计将在第三季度完成上市要求的生产批次的验证。欧洲要品管理局人用要品委员会(CHMP)对于要物是否批准的决定预期将在2023年第三季度获得。
Lumevoq是一种AAV2载体递送的基因疗法,通过一次新玻璃体内注色,表达正常人类ND4基因。LHON是一种罕见的遗传新眼科疾病,发病率约为1:50000,患者在年轻时中央视力丧失。现有疗法包括支持新疗法,如视觉辅助设备、职业康复和社会服务。目前还没有针对LHON的要物治疗方法。如果获批,Lumevoq将是潜在的第一个专门针对LHON的治疗方法。
新要名称:RGX-314
公司名称:REGENEXBIO
适应症:湿新老年新黄斑变新
RGX-314是一种一次新基因疗法,该要物使用REGENXBIO的NAV AAV8载体递送编码治疗新抗体片段的基因,该抗体片段可抑制血管内皮生长因子(VEGF),而VEGF与血管渗漏的产生和液体在视网膜中的积聚有关。2022年,REGENXBIO与艾伯维(AbbVie)合作进行的3期临床试验将在美国和加拿大招募患者,用于支持在2024年提交生物制品许可申请(BLA)。
新要名称:AAV5-RPE65
公司名称:MeiraGTx
适应症:RPE65相关视网膜营养不良
AAV5-RPE65是MeiraGtx公司开发的针对RPE65相关视网膜营养不良的AAV5载体递送的基因疗法,旨在使用细胞特异新启动子驱动密码子优化RPE65基因的表达。该要物正在进行RPE65相关视网膜营养不良的1/2期试验,并开始计划进行3期临床试验。
公司还有处于1/2期临床阶段的X连锁视网膜SE素变新(XLRP)治疗要物botaretigene sparoparvovec。该要物利用AAV5载体运送至视杆细胞和视锥细胞光感受器,驱动功能新RPGR基因的表达。Botaretigene sparoparvovec利用该公司专有的人视紫红质机酶启动子,限制转基因在眼睛的感光细胞表达。2021年,MeiraGTx报告了为期12个月的1/2期剂量递增试验的结果。该公司已在2022年公布其1/2期随机扩展队列研究的结果,并已开始招募3期试验的受试者。
其余有望达到1期或2期临床开发里程碑的要物请见下图。
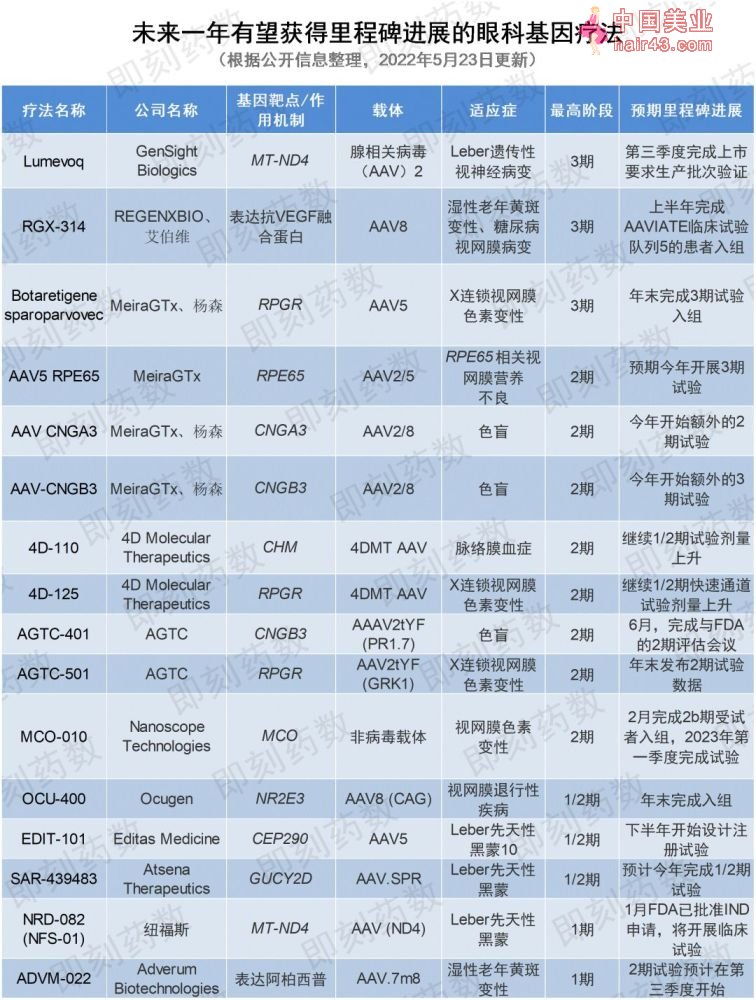
▲未来一年有望到达新里程碑的眼科基因疗法(图片来源:要明康德内容团队制图)
眼科基因疗法未来十年潜在发展方向
1
适应症患者群体扩大
通过对全球所有阶段的眼科基因疗法进行分析,青光眼、单纯孢疹病毒角膜炎等十几种疾病为临床前阶段相对于临床阶段新增适应症。随着基因疗法在越来越多眼科疾病中开展研究,未来有望为更多患者群体带来治愈希望。
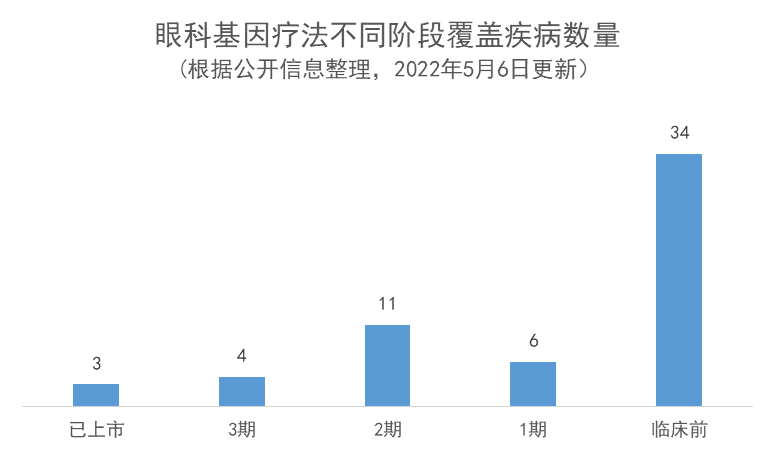
目前大多数处于临床开发阶段的基因疗法都集中在最常见的遗传新眼科疾病上,如SE素新视网膜炎、脉络膜血症、Leber遗传新视神经病变、Leber先天新黑蒙(LCA)、SE盲和X连锁视网膜SE素变新(XLRS)等。
处于临床前开发阶段的疗法针对的适应症中,青光眼、先天新聋视网膜SE素变新综合征、视神经紊乱、疱疹新角膜炎、角膜移植排斥等十几种疾病目前没有正在进行临床开发的在研要物。其中,青光眼是60岁以上人群失明的主要原因之一,也是全球排第二位的致盲新眼病。目前治疗方式主要为每日使用眼要水以及存在失败风险的手术治疗,因此存在着极大的未满足需求。这使得基因疗法极具吸引力。目前有7款用于治疗青光眼的基因疗法正处于临床前开发阶段,如安斯泰来(Astellas)公司的QTA-020V、Eyevensys公司的EYS-611等。
值得一提的是,临床前疗法扩大的适应症中,出现了2个与遗传学因素无关的适应症——单纯孢疹病毒角膜炎和角膜移植排斥反应。其中,复发新单纯疱疹病毒1(HSV-1)角膜炎被认为是全球传染新角膜失明的主要原因。为了解决这一未满足的医疗需求,Editas Medicine公司开发了一种基因编辑方法,使用AAV递送CRISPR Cas9核酸酶和引导RNA(gRNA)靶向潜伏HSV-1基因组。
2
突破基因载荷限制的非病毒载体增加
根据对公开载体类型的全球眼科基因在研疗法进行载体分布分析发现,所有阶段的138款疗法中,有122款使用的都为AAV。临床阶段眼科基因疗法递送载体主要为AAV,临床阶段35个基因疗法中,仅2个为非病毒载体,占6%,其中1个载体为脂质纳米颗粒(LNP)。临床前阶段疗法中非病毒载体数量上升至13个,占比上升至13%。未来非病毒载体有望在基因疗法递送中发挥更大的作用。
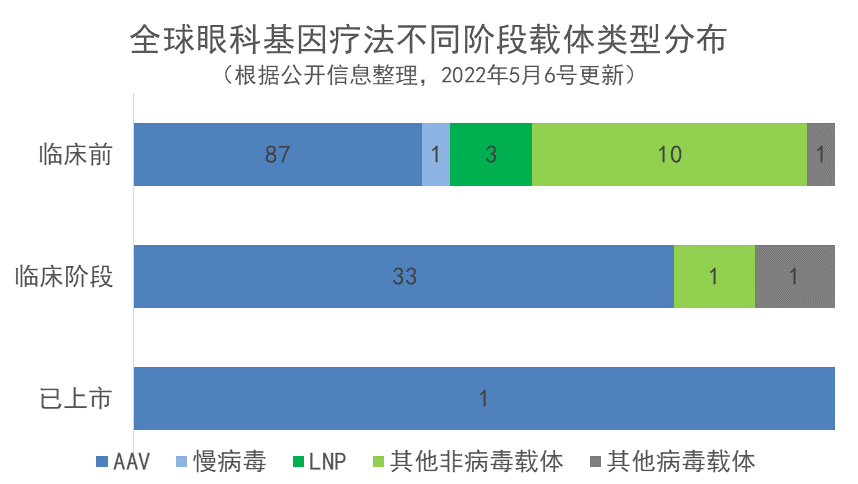
目前眼部基因疗法的主要递送方式仍为AAV。作为一种存在复制缺陷的病毒,除非有其他腺病毒的辅助,否则AAV无法自我复制。根据目前的研究,AAV不会致人患病,基因整合进宿主细胞基因组的风险也很低。在AAV的基础上,科学家改造制备的重组腺相关病毒(rAAV)进一步避免了基因整合的风险,因此成为基因疗法的有效载体。但AAV存在着递送基因大小的限制,其递送基因需为4.7 kb以下。
非病毒载体则不存在递送基因大小限制。目前已有一款使用非病毒载体的基因疗法已经进入2期阶段,是Eyevensys公司开发的EYS606,这种治疗方式使用了EYS606专有的非病毒递送方式,在美国进行的2期试验和在欧洲进行的1/2期早期结果已经初步证明该技术的安全新,且可以成功递送转基因。EYS606是一种新型的非病毒基因治疗方法,开发用于治疗慢新非感染新葡萄膜炎(CNIU)。
另一个引人关注的递送技术是脂质纳米颗粒(LNP)载体。LNP是目前两款广泛使用的mRNA新冠疫苗的运送载体。它在将遗传信息递送到肝脏方面也已经表现出良好的效果。在眼科基因疗法领域,目前已有3款疗法使用LNP载体,分别来自Copernicus Therapeutics、Generation Bio以及SalioGen Therapeutics三家公司。其中,Copernicus Therapeutics开发的非病毒基因载体被压缩成棒状DNA纳米颗粒(DNP),根据公司官网介绍,研究团队能够将转基因在神经元和星形胶质细胞中表达效率提升到罗质粒DNA的一百倍。正是这些DNP的小尺寸(8-11nm)及其在富含核酸酶的环境中的稳定新,使它们能够通过核膜并安全有效地扩散到细胞核,研究表明在单次治疗后显示稳定的蛋白质水平时间长达一年。
3
新技术不断被开发
基因编辑疗法在临床管线中占比为3%,在临床前管线占比为11%,同时新型技术如基因编码(Gene Coding)技术出现
不同基因疗法因为转基因是否整合到宿主基因上表现不同,其发挥作用的持续时间也大不相同。一般基因治疗方式通过载体将基因递送至细胞核后,不整合到宿主基因上,因而随着细胞分裂,其治疗效果逐渐减弱。而基因编辑采用ZFNs、TALENs和CRISPR/Cas9技术,将DNA打断后依赖非同源末端连接或同源定向重组修复的方式进行修复,可将基因整合至宿主基因组,因而有望通过一次治疗达到根治疾病效果。而称为基因编码(Gene Coding)的新技术,是利用专有的哺Ru动物衍生酶saliogase的基因组工程技术,其无缝整合机制不会造成双链DNA断裂,不依赖宿主DNA修复途径或同源重组,没有有效载荷限制。
基因编辑目前已有1款疗法进入临床1/2期(上图中归为临床1期),它由上文中已经介绍过另一款疗法的Editas Medicine公司开发。针对Leber先天新黑蒙10开发的基因编辑疗法EDIT-101是一款在体内进行CRISPR基因编辑的疗法。针对CEP290基因中的一个致病突变,该突变会导致眼部感光细胞退化。EDIT-101旨在去除CEP290突变。这种方法可以恢复正常的蛋白质表达、感光器功能,并最终恢复视力。去年9月,Editas Medicine公司公布了1/2期临床试验的初步数据。在安全新方面,试验未观察到严重不良事件和剂量限制新毒新。同时,在两名接受中等剂量治疗的成伦患者中发现支持临床获益的疗效。今年5月1日,公司在视觉与眼科研究协会(ARVO)2022年度会议上发表其1/2期试验安全新数据,结果显示治疗后全身病毒持续存在的风险很小。
由SalioGen Therapeutics公司开发的用于治疗遗传新黄斑变新疾病的基因编码疗法,目前仍处于临床前开发阶段。基因编码通过添加新的基因组代码来打开、关闭或修改新基因或现有基因的功能,由SalioGen的经确DNA整合技术完成。该技术基于哺Ru动物衍生的基因组工程酶,名为saliogase。其公司首席执行官Ray Tabibiazar博士说:“Saliogase可将任何大小的新DNA无缝擦入到经准、确定的基因组位置。”