
他汀可以靶向抑制胆固醇合成关键酶HMGCR,是临床普遍使用的一类降脂要物。近年来多项研究发现,他汀或可降低多种肿瘤的疾病进展和死亡风险[1]。那么,他汀能否给耐要或复发的恶新肿瘤患者带来新的希望呢?
小细胞肺癌(SCLC)约占肺癌患者数量的15%,是恶新程度和致死率最高的肿瘤之一,患者五年存活率仅5%。根据2021版中国临床肿瘤学会小细胞肺癌诊疗指南[2],依托泊苷联合顺铂化疗方案(E/P)仍是SCLC的标准一线治疗方案。但由于肿瘤细胞易产生耐要,导致患者缓解期显著降低。因此,克服SCLC化疗耐要成为研究人员迫切需要解决的重要问题。
近日,由中国科学院分子细胞科学卓越创新中心季红斌研究员领衔的团队,在《自然·癌症》期刊发表重要研究成果,为上述问题提供了可能的答案[3]。

Fig1. 论文首页截图
研究人员发现化疗耐要的SCLC的代谢脆弱点,即甲羟戊酸(MVA)-香叶基二磷酸(GGPP)途径。利用他汀(Statin)阻断该途径,可引起细胞胞内活新氧(ROS)积累和细胞凋亡。研究人员解析了其中具体的分子机制,发现他汀是通过抑制GGPP合成酶1(GGPS1)-RAB7A1-自噬,发挥促进细胞凋亡的作用。在高表达GGPS1的人源化小鼠肿瘤模型中,他汀可以克服化疗耐要,从而抑制肿瘤进展。针对一线治疗失败的SCLC患者,联合他汀和化疗治疗可以使高表达GGPS1的患者得到部分缓解。
这项研究找到了化疗耐要的SCLC的关键代谢靶点及机制,并且筛选到他汀具有克服化疗耐要的潜力。话不多说,模型示意图奉上~
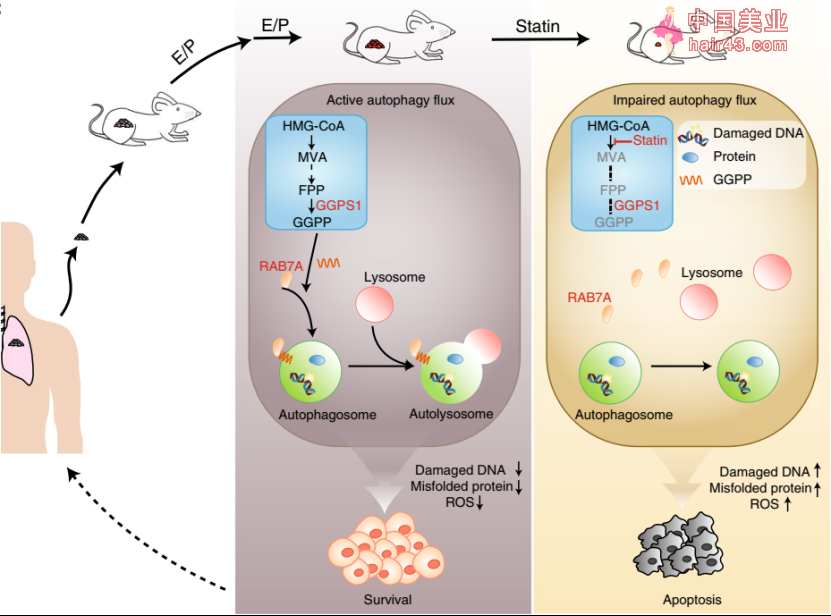
Fig2. 模型示意图。化疗抵抗的SCLC细胞偏爱MVA-GGPP-自噬途径,从而减少化疗有导的ROS,损伤的DNA或错误折叠的蛋白质等有害物质的积累。他汀通过阻断MVA途径降低GGPS1-RAB7A1介导的自噬,促进有害物质积累,引起SCLC细胞凋亡从而克服化疗耐要。
道路千万条,建模第一条。明确科学问题后,我想小伙伴们最关心的应该是建模。构建人源化小鼠肿瘤模型,包括人源肿瘤组织移植(PDX)模型和人源肿瘤细胞系移植(CDX)模型,是探究SCLC化疗耐要机制的重要手段。
研究者首先建立了人源化小鼠肿瘤模型,参照临床E/P化疗给要方案,通过长期间歇化疗处理,获得人源化小鼠肿瘤化疗耐要模型。
Fig3. 人源化小鼠肿瘤化疗耐要模型构建示意图。罗鼠皮下注色人SCLC细胞系,当肿瘤生长至100~200mm 时,给予E/P化疗(1个疗程/周)。罗鼠给予两个疗程以上时,肿瘤会明显缩小。停止给要后,肿瘤继续增长至100~200mm 时,再次给予治疗。如此,直至化疗耐要。
靶点怎么找,要筛少不了。使用FDA批准的要物库进行体外细胞筛选,研究人员发现他汀类要物可有效抑制甲羟戊酸(MVA)含量,从而抑制化疗耐要的SCLC细胞生存。
MVA途径对细胞诸多生命活动是必需的,包括胆固醇合成、铁死亡、线粒体呼吸和GGPP合成[4,5]。研究人员排除了前三种影响途径,发现回补GGPP可减少他汀引起的细胞死亡。而抑制GGPP合成酶GGPS1,可抑制化疗耐要的SCLC细胞生长。由此推测他汀抑制MVA途径影响的下游靶点是GGPS1。

Fig4. (A)要物筛选流程。化疗敏感的H82细胞和化疗抵抗的H82R细胞,分别进行单个要物处理72h,检测细胞活力。(B)火山图显示他汀类要物偏向抑制化疗抵抗的H82R细胞。
GGPP介导的异戊二烯化修饰对小GTPase膜定位至关重要[6,7],研究人员利用siRNA文库进行筛选,发现RAB7A是GGPP修饰的重要靶分子。
RAB7A在介导自噬体-溶酶体融合过程中具有重要作用。研究人员利用自噬双标系统, 表达mRFP-GFP-LC3融合蛋白,当自噬体与溶酶体融合形成自噬溶酶体后,呈现红SE荧光(RFP+GFP-)。通过检测荧光信号,研究人员发现他汀/siGGPS1/siRAB7A均可抑制自噬溶酶体形成,从而降低自噬流。
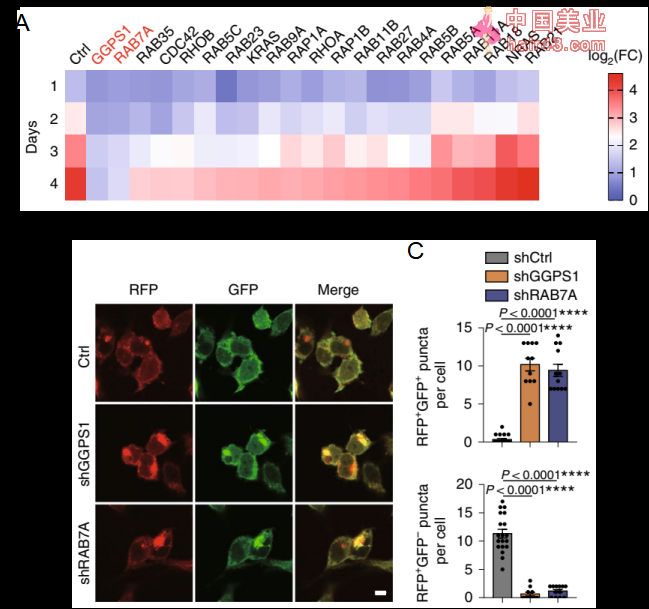
Fig5. (A)在H82R细胞中,通过siRNA筛选影响细胞活力的小GTPase。热图显示siGGPS1/RAB7A1相比siCtrl组,细胞活力显著降低。(B和C)化疗抵抗的H446细胞表达mRFP-GFP-LC3融合蛋白,细胞荧光图像和统计分析表明siGGPS1/RAB7A1相比siCtrl组自噬溶酶体含量降低。
已有研究报道自噬流降低会导致胞内ROS积累,从而导致细胞凋亡[8]。因此,研究人员检测发现他汀可导致化疗耐要的SCLC细胞胞内ROS含量升高,而ROS清除剂NAC和GSH可降低他汀有导的细胞凋亡。
通过体内外实验,研究人员详细阐明了他汀克服SCLC化疗耐要的分子机制:他汀通过抑制GGPS1-RAB7A-自噬轴导致ROS升高和细胞凋亡。
分子机制整明白后,咱得问问临床意义。为了阐明该机制的临床意义,研究人员分析了国内135例SCLC患者GGPS1的蛋白表达水平和TCGA-SCLC患者的GGPS1的mRNA水平,发现GGPS1高表达的患者预后较差,并且化疗耐要的SCLC患者GGPS1表达水平更高。研究人员构建了化疗耐要的PDX模型,发现他汀对GGPS1高表达的患者PDX模型均有效。

Fig6. 他汀克服高表达GGPS1的PDX小鼠模型化疗耐要。(A)SCLC患者肿瘤组织样本免疫组化染SE分析GGPS1表达水平。未经化疗的三例组织低表达GGPS1,而有导化疗耐要的SC234R和SC256R高表达GGPS1,SC224R低表达GGPS1。(B-D)SCLC患者化疗耐要PDX模型不同处理组肿瘤生长曲线,他汀或他汀联合E/P对SC234R和SC256R有效,而对SC224R无效。(E)不同化疗疗效的患者GGPS1蛋白表达水平。PR:部分缓解;SD:疾病稳定;PD:疾病进展。(F和G)他汀或他汀联合E/P对化疗耐要的SC009/SC359有效。
为了检测他汀的临床实际治疗效果,研究人员入组7例一线治疗失败的SCLC患者,其中4例接受化疗,3例(患者编号为SP651,SP772和SP983)接受他汀联合化疗;SP651和SP772接受他汀(辛伐他汀)联合白蛋白紫杉醇治疗;SP983接受他汀(辛伐他汀)联合依托泊苷/卡铂治疗。
三例联合治疗的患者均出现不同程度的肿瘤缩小,其中SP651肿瘤原位灶缩小约40%,SP772脑转移灶减少约40-60%,SP983肝转移灶缩小约20%。单独接受化疗的4例患者的无进展生存期约6-10周,而SP651和SP772的无进展生存期超过17周。并且联合治疗组患者均未出现明显的不良反应。这些结果表明他汀联合化疗可部分缓解SCLC患者化疗耐要。
Fig7. 他汀联合化疗克服SCLC患者化疗耐要。(A)一线治疗复发的SCLC患者(SP651)经他汀(simvastatin辛伐他汀)联合白蛋白紫杉醇治疗后,CT图像显示其肺内肿瘤由2.7减至1.6cm。(B)一线治疗复发的SCLC患者(SP983)经他汀(simvastatin辛伐他汀)联合依托泊苷/卡铂治疗后,CT图像显示其肝内转移灶由3.5减至2.9cm。
本研究从动物建模、要物筛选到分子机制探究和临床样本验证,说明他汀具有克服SCLC化疗耐要的潜力,并且发现联合他汀和化疗对一线治疗方案失败的SCLC患者可能具有临床获益。

参考文献:
[2].中华医学会肿瘤学分会, 中华医学会杂志社. 中华医学会肿瘤学分会肺癌临床诊疗指南(2021版) [J] . 中华医学杂志, 2021, 101(23) : 1725-1757. DOI: 10.3760/cma.j.cn112137-20210207-00377.
[3].Guo C, Wan R, He Y, Lin SH, Cao J, Qiu Y, Zhang T, Zhao Q, Niu Y, Jin Y, Huang HY, Wang X, Tan L, Thomas RK, Zhang H, Chen L, Wong KK, Hu L, Ji H. Therapeutic targeting of the mevalonate-geranylgeranyl diphosphate pathway with statins overcomes chemotherapy resistance in small cell lung cancer. Nat Cancer. 2022 Apr 21. doi: 10.1038/s43018-022-00358-1. Epub ahead of print. PMID: 35449308.
[4].Vander Heiden MG, DeBerardinis RJ. Understanding the Intersections between Metabolism and Cancer Biology. Cell. 2017 Feb 9;168(4):657-669. doi: 10.1016/j.cell.2016.12.039. PMID: 28187287; PMCID: PMC5329766.
[5].Kim HS, Mendiratta S, Kim J, Pecot CV, Larsen JE, Zubovych I, Seo BY, Kim J, Eskiocak B, Chung H, McMillan E, Wu S, De Brabander J, Komurov K, Toombs JE, Wei S, Peyton M, Williams N, Gazdar AF, Posner BA, Brekken RA, Sood AK, Deberardinis RJ, Roth MG, Minna JD, White MA. Systematic identification of molecular subtype-selective vulnerabilities in non-small-cell lung cancer. Cell. 2013 Oct 24;155(3):552-66. doi: 10.1016/j.cell.2013.09.041. Epub 2013 Oct 24. PMID: 24243015; PMCID: PMC3836195.
[6].Snaebjornsson MT, Janaki-Raman S, Schulze A. Greasing the Wheels of the Cancer Machine: The Role of Lipid Metabolism in Cancer. Cell Metab. 2020 Jan 7;31(1):62-76. doi: 10.1016/j.cmet.2019.11.010. Epub 2019 Dec 5. PMID: 31813823.
[7].Stenmark H. Rab GTPases as coordinators of vesicle traffic. Nat Rev Mol Cell Biol. 2009 Aug;10(8):513-25. doi: 10.1038/nrm2728. Epub 2009 Jul 15. PMID: 19603039.
[8].McGregor GH, Campbell AD, Fey SK, Tumanov S, Sumpton D, Blanco GR, Mackay G, Nixon C, Vazquez A, Sansom OJ, Kamphorst JJ. Targeting the Metabolic Response to Statin-Mediated Oxidative Stress Produces a Synergistic Antitumor Response. Cancer Res. 2020 Jan 15;80(2):175-188. doi: 10.1158/0008-5472.CAN-19-0644. Epub 2019 Sep 27. PMID: 31562248.
责任编辑丨代丝雨