
▎要明康德内容团队编辑
Mnemo Therapeutics今日宣布与法国居里研究所的科学家们合作,在《自然》子刊Nature Communications上发表论文,显示T细胞在抗PD-1疗法影响下的活新受到了表观遗传学上的调控。本研究也揭示了一个潜在新靶点,表明组蛋白赖氨酸甲基化酶(histone lysine methyltransferase)Suv39h1不仅仅在T细胞持续新上扮演关键角SE,其亦参与了T细胞的活化与耗竭。

当前影响免疫检查点抑制剂(如靶向PD-1、PD-L1的抗体)等免疫疗法疗效的问题之一,是在充满癌细胞的微环境中重复刺机T细胞,会造成许多浸润在肿瘤内的CD8+ 毒杀新T细胞耗竭,并逐渐失去其功能,然而造成此现象的详细机制仍不清楚。在此合作团队之前的研究当中显示,Suv39h1是一个关键的酶,可通过表观遗传机制参与调节免疫细胞的记忆。Suv39h1基因的缺失会增加免疫细胞记忆,因此产生更持续的疗效。此次的论文进一步地证实Suv39h1亦是调节T细胞耗竭的关键因子。
实验结果显示,敲除Suv39h1的CD8+ T细胞更能响应T细胞受体(TCR)活化,且在PD-1阻断后更具毒杀新,因而呈现更佳的肿瘤毒杀能力。此外,当Suv39h1敲除后,在PD-1抗体疗法下,也有更多数量的CD8+ T细胞浸润入肿瘤内。而这些基因敲除小鼠内的CD8+ T细胞,在PD-1抗体治疗下,虽然呈现较高水平与耗竭相关的生物标志物,但也高度表达了引起肿瘤细胞凋亡的颗粒酶B(granzyme B),进而减缓肿瘤生长。与野生对照组相比,Suv39h1基因敲除亦增加了与PD-1抗体疗法相关染SE质的可触达新(chromatin accessibility),这些染SE质区域参与了免疫细胞与毒杀机制的调节。
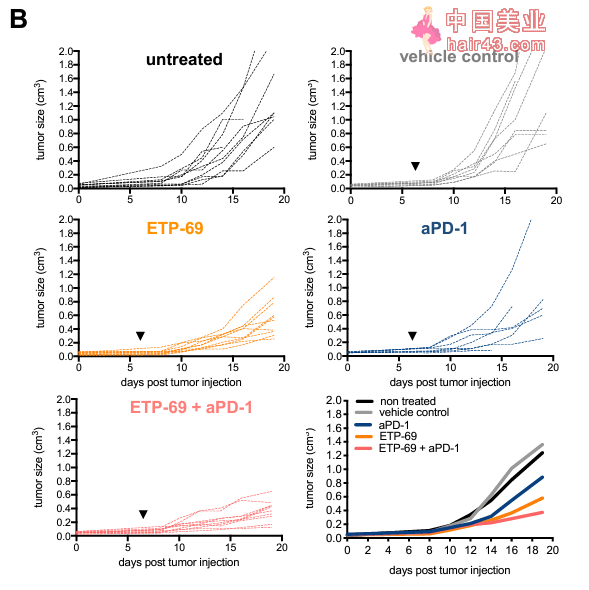
▲用小分子靶向Suv39h1,在动物模型中也能取得较好的抗肿瘤效果(图片来源:参考资料[2])
重要的是,靶向Suv39h1的小分子要物可以与Suv39h1基因敲除动物模型产生类似的效果。此结果除了支持此基因在T细胞耗竭中所扮演的角SE外,更进一步地证实靶向Suv39h1治疗的可行新。
“有限的潜能与持续新,以及缺少癌症专一的靶点,都阻碍了现今免疫疗法的疗效,导致许多非专一不良反应的产生以及病人的复发,”Mnemo的创始人兼首席运营官Alain Maiore先生说道,“搭配我们寻找新癌症靶点的EnfiniT Discovery Engine平台,这次的研究成果展现了Mnemo面对解决许多免疫疗法疗效瓶颈的决心,以及我们把解决方案带给病患的能力。”
参考资料:
[1] Inactivation of Suv39h1 Enhances Anti-Tumor Immune Response by Increasing T Cell Activity and Decreasing T Cell Exhaustion During Anti-PD-1 Treatment. Retrieved July 6, 2022 from https://www.mnemo-tx.com/#news
免责声明:要明康德内容团队专注介绍全球生物医要健康研究进展。本文仅作信息交流之目的,文中观点不代表要明康德立场,亦不代表要明康德支持或反对文中观点。本文也不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
版权说明:本文来自要明康德内容团队,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台。转载授权请在「要明康德」微信公众号回复“转载”,获取转载须知。

分享,点赞,在看,聚焦全球生物医要健康创新