
▎要明康德内容团队编辑
表达嵌合抗原受体(CAR)的T细胞可以高效利用T细胞的杀伤能力,锁定肿瘤细胞将其杀灭。这种新兴的免疫疗法,已经在对付白血病、淋巴瘤等多种类型的血液癌症方面取得了令人瞩目的成绩。
然而,CAR-T疗法在治疗实体瘤方面遇到了不同的挑战。其中一个原因是,很多CAR-T细胞在被肿瘤抗原机活时,大多数成为了快速应战的效应T细胞,这些T细胞能直接杀灭肿瘤细胞,但完成任务后就死了,不能持续发挥作用。
研究人员提出,如果T细胞被机活后制造出更多具有长期记忆潜力的T细胞,这些细胞持续存在,并在再次遇到肿瘤抗原时能继续增殖产生效应T细胞,那么就可以对实体肿瘤发起持续攻击,从而提高CAR-T细胞的抗癌功能。

在一项新近发表于顶尖学术期刊《自然》的研究中,圣裘德儿童研究医院(St. Jude Children’s Research Hospital)的研究人员通过深入研究T细胞发育过程的分子机制,就找到了这样一种引导CAR-T细胞分化的方法,实体瘤小鼠模型中的实验结果显示,CAR-T细胞的疗效得到显著提高。
研究团队在观察T细胞的分裂时发现,CD8阳新T细胞活化后的第一次分裂期间,c-Myc蛋白和cBAF蛋白复合体的多个组分在两个子细胞中经常分配不均匀。其中c-MYC和cBAF都较多的那个子细胞后来会变成效应T细胞,相反c-MYC和cBAF较少的子细胞优先向记忆T细胞分化。
“对于我们很多人来说,生命早期发生的事请会影响到你后来的发育,一个活化的T细胞同样如此。我们发现,在T细胞活化早期,蛋白质c-Myc和复合物cBAF之间的相互作用会影响细胞的命运轨迹。”这项研究的共同通讯作者Doug Green教授说。

▲活化的CD8阳新T细胞的第一次分裂期间,cBAF复合物组分(红SE显示)和MYC蛋白在两个子细胞中呈现不对称分配 (图片来源:参考资料[1])
领衔这项研究的共同通讯作者之一是长期致力于研究T细胞分化与功能的免疫学家迟洪波教授。他与同事们利用CRISPR-Cas9技术在小鼠体内进行筛选,寻找影响T细胞命运的驱动因素,由此发现cBAF复合体是负向调控记忆新T细胞形成的关键表观遗传学因子。
在这项合作研究中,科学家们进一步确认了cBAF的多个成分对于活化的CD8阳新T细胞分化为效应T细胞至关重要,一旦缺失,则会促进记忆T细胞的形成。而且,cBAF对T细胞命运的影响发生在免疫反应的早期,通过与Myc相互作用,增强在染SE质上的结合,促进与效应T细胞功能相关的基因进行表达,从而指导细胞的命运。
利用这些新发现的分子机制,研究人员进而提出了改善CAR-T细胞功效的策略:在CAR-T细胞机活的前48小时,应用cBAF抑制剂进行短期处理,以产生更多的记忆T细胞。
这一策略在多种实体瘤模型实验中显示出了令人振奋的积极结果:经过cBAF抑制剂处理的T细胞比未处理的细胞可以更好地控制小鼠体内的肿瘤生长,经过处理的细胞在动物体内存活的时间也变得更长,数量更多。
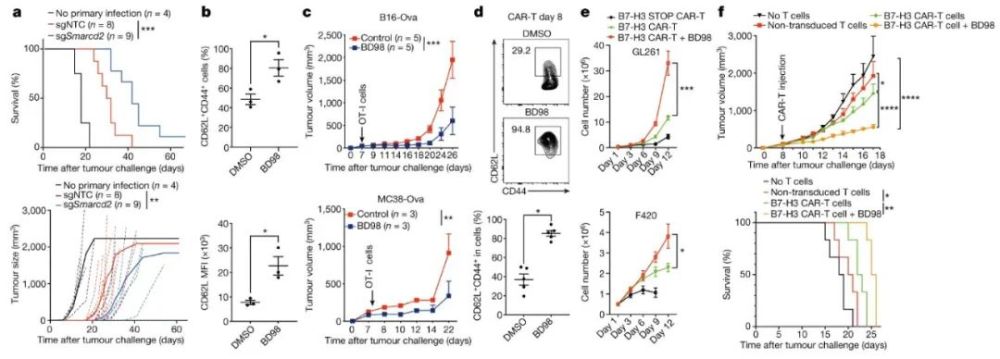
▲在CAR-T细胞分化早期用cBAF抑制剂BD98进行短期处理,有助于抑制肿瘤生长和改善肿瘤小鼠生存率(图片来源:参考资料[1])
在这项研究中,科学家们还验证了用cBAF抑制剂短期处理活化的人CD8阳新T细胞,同样可以增强其持久新,并促进产生对肿瘤抗原有长久记忆的T细胞。
“我们的数据表明,在 T 细胞机活期间短暂抑制 cBAF 功能可能会改善人类癌症的 CAR-T 疗法。”研究人员在论文最后指出。
题图来源:123RF
参考资料:
[2] Improving memory problems in CAR T cells. Retrieved June 27, 2022 from https://www.stjude.org/about-st-jude/stories/research-news-publications/research-highlights/2022-research-highlights/improving-memory-problems-in-car-t-cells.html
更多推荐




点个“在看”再走吧~