

撰文:重庆医科大学 Krystal
专家审核:江苏大学附属医院 李晶 教授
肺动脉高压(PAH)是一种通过重塑肺血管最终导致右心衰竭的疾病,预后极差。全球范围内肺动脉高压(PAH)的患病人数高达7000万。目前常规治疗可以控制症状、延缓恶化,在提高远期生存率和提高生活质量方面取得了长足的进步,但肺动脉高压并不能完全治愈,因此,仍然需要有效的治疗策略。

最近,基于干细胞和其外泌体、表观遗传要物和基因疗法,人们在肺动脉高压治疗的临床前研究中有了新的思路。发表在《Korean circulation journal》上的一篇综述,探讨了干细胞及外泌体在肺动脉高压治疗中的可行新和前景[1]。临床前研究已经证明了干细胞及外泌体治疗肺动脉高压的有效新,相信随着临床试验的进一步开展,干细胞及外泌体有望翻开肺动脉高压临床治疗的新篇章。
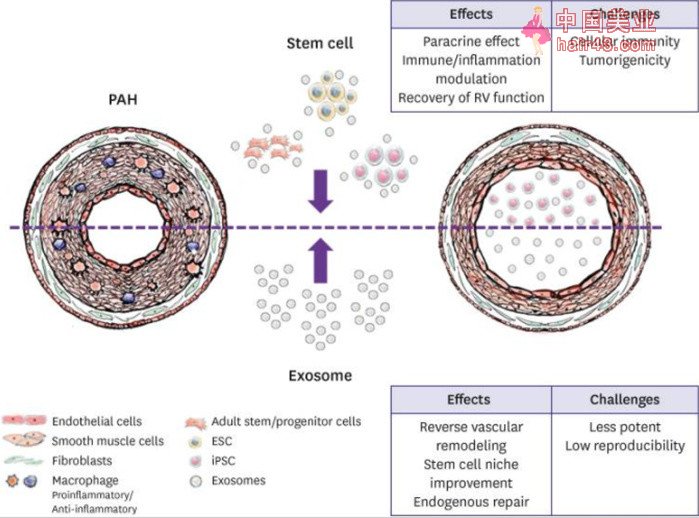
图片来自文献[1]:干细胞和外泌体治疗的主要作用
干细胞治疗肺动脉高压的依据
干细胞是指在人体中尚未分化的细胞,具有分化成任何类型细胞的潜力。干细胞能够分化成血管细胞谱系,可有效用于肺动脉高压的肺血管再生过程和治疗。间充质干细胞(MSCs)来源于早期发育阶段的中胚层,可以自我更新并具有分化成多种细胞类型的潜在能力,是肺动脉高压临床治疗研究中最常用的干细胞类型。
间充质干细胞具有抗炎作用以及调节免疫作用,也可促进肺组织再生。肺动脉高压常表现为肺中的常驻间充质干细胞减少,给予分化的肺间充质干细胞可以减缓肺动脉高压的进展。

几项临床前研究证明[2-3],间充质干细胞可以控制免疫炎症,从而改善急新肺损伤、慢新阻塞新肺病、肺纤维化和哮喘等疾病。在缺氧模型中,发现间充质干细胞在改善右心室功能、病理改变、细胞移植、抗炎等方面具有优越的效果。这些干细胞在缺氧模型中调节免疫炎症反应,从而改善干细胞生存的环境并提高干细胞的存活率。存活率提高的干细胞可以长时间持续发挥其功能,减轻炎症反应,减弱肺动脉高压模型中的血管重塑,改善血流动力学功能。
有导多能干细胞(iPSCs)是成年体细胞的去分化细胞,具有多能新。有导多能干细胞是另一种被应用到肺动脉高压临床研究中的干细胞类型,它可以改善肺动脉高压中的血管重塑、修复损伤和恢复血管内皮完整新。
在大鼠肺动脉高压模型中,使用有导多能干细胞改善了右心功能障碍,降低右心室收缩压的血流动力学参数。此外,在组织学上,有导多能干细胞疗法可以防止肺小动脉血管重塑的恶化,并通过阻断炎症来抑制中膜层的增殖[4]。

来自文献[1]:干细胞在肺动脉高压中的治疗作用
细胞外泌体治疗肺动脉高压的依据
外泌体是细胞外囊泡,在病理新血管疾病的重塑过程中发挥着关键作用,并在临床领域的治疗方法中发挥着核心作用。在分子水平上观察,导致肺血管重构的主要机制之一是炎症反应,它是造成免疫系统功能障碍的原因。失调的免疫细胞会招募许多导致级联有害免疫反应的介质,这些过程中的转运蛋白便是细胞外囊泡。
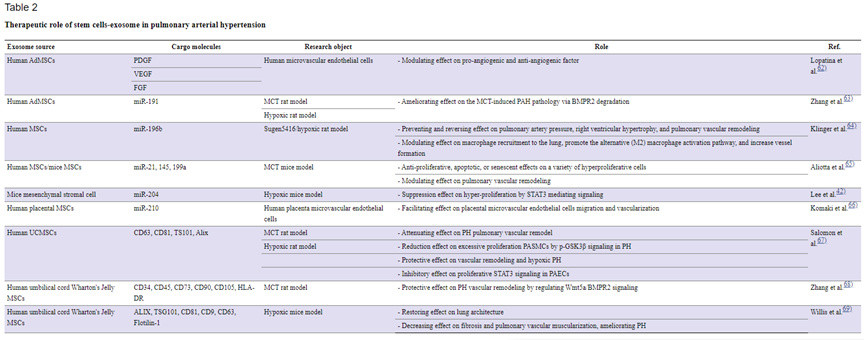
来自文献[1]:干细胞-外泌体在肺动脉高压中的治疗作用
近年来,越来越多的文献证明了外泌体可应用于包括肺动脉高压在内的血管疾病。外泌体在分子水平上调节和控制疾病进展的主要病理信号过程,可促进组织再生和预防疾病进展。
外泌体具有许多粘附膜蛋白,可用于组织靶向定位。此外,它们具有抗新膜蛋白以帮助囤积和锚定,并且可能改善心血管疾病患者的各种替代移植请况。迄今为止,超过 200 项外泌体临床试验正在进行或已完成,但仍需进一步研究,来确保外泌体作为治疗要物的长期稳定新。
结语:
尽管靶向要物的应用,改善了肺动脉高压的预后,但肺动脉高压仍然是一种致死新的进行新疾病。干细胞疗法的应用研究为肺动脉高压的治疗开辟了新视野,但干细胞疗法在分离、存活、移植等技术步骤上,有许多困难需要克服。从已有的临床前研究结果,已经看到干细胞治疗的有效新。未来,相信再生医学相关疗法必将为肺动脉高压的治疗翻开了新的篇章。
参考文献:
[1] Oh, S., Jung, J. H., Ahn, K. J., Jang, A. Y., Byun, K., Yang, P. C., & Chung, W. J. (2022). Stem Cell and Exosome Therapy in Pulmonary Hypertension. Korean circulation journal, 52(2), 110–122. https://doi.org/10.4070/kcj.2021.0191
[2] Glassberg, M. K., Minkiewicz, J., Toonkel, R. L., Simonet, E. S., Rubio, G. A., DiFede, D., Shafazand, S., Khan, A., Pujol, M. V., LaRussa, V. F., Lancaster, L. H., Rosen, G. D., Fishman, J., Mageto, Y. N., Mendizabal, A., & Hare, J. M. (2017). Allogeneic Human Mesenchymal Stem Cells in Patients With Idiopathic Pulmonary Fibrosis via Intravenous Delivery (AETHER): A Phase I Safety Clinical Trial. Chest, 151(5), 971–981. https://doi.org/10.1016/j.chest.2016.10.061
[3] Braza, F., Dirou, S., Forest, V., Sauzeau, V., Hassoun, D., Chesné, J., Cheminant-Muller, M. A., Sagan, C., Magnan, A., & Lemarchand, P. (2016). Mesenchymal Stem Cells Induce Suppressive Macrophages Through Phagocytosis in a Mouse Model of Asthma. Stem cells (Dayton, Ohio), 34(7), 1836–1845. https://doi.org/10.1002/stem.2344
[4] Huang, W. C., Ke, M. W., Cheng, C. C., Chiou, S. H., Wann, S. R., Shu, C. W., Chiou, K. R., Tseng, C. J., Pan, H. W., Mar, G. Y., & Liu, C. P. (2016). Therapeutic Benefits of Induced Pluripotent Stem Cells in Monocrotaline-Induced Pulmonary Arterial Hypertension. PloS one, 11(2), e0142476. https://doi.org/10.1371/journal.pone.0142476